Китайское исследование трансплантации фекальной микробиоты пациентам с желудочно-кишечными расстройствами и после COVID-19
Лихорадка и кашель — наиболее частые клинические проявления COVID-19. Кроме того, заболевание также может вызывать симптомы со стороны пищеварения, такие как тошнота и диарея [1, 2], которые часто недооцениваются [3]. Помимо этого, у пациентов с COVID-19 также были распространены лимфопения и гиперцитокинемия, что позволяет предположить, что COVID-19 может компрометировать иммунную систему [4, 5]. Наличие как лимфопении, так и гиперцитокинемии у пациентов с COVID-19 может указывать на тяжесть протекания инфекции, как это ранее было выявлено во время пандемии коронавируса (SARS-CoV) в 2003 году [6, 7].
Десятки триллионов микроорганизмов колонизируют поверхности слизистых оболочек человеческого тела, таких как кишечник и дыхательные пути. В последние десятилетия появилось множество доказательств благотворного влияния бактерий-комменсалов, особенно пробиотиков. Также исследования показали, что бактерии-комменсалы имеют не только решающую роль в поддержании иммунного гомеостаза кишечника, но и заметно влияют на иммунный ответ в других слизистых оболочках, в частности в дыхательных путях, оказывая защитное действие против респираторного вируса гриппа [8]. Siew C и др. наблюдали стойкие изменения в фекальной микробиоте во время госпитализации пациентов, инфицированных SARS-CoV-2, поэтому нацеливание на микробиоту кишечника является новым терапевтическим подходом или, по крайней мере, выбором для адъювантной терапии COVID-19 [9].
Трансплантация фекальной микробиоты (ТФМ) — это эффективный способ восстановления микробиоты кишечника [10], который, как сообщается, повышает иммунитет и может являться потенциальной терапией для людей с инфекцией [11–14]. Bradley и др. сообщили, что лечение антибиотиками может уменьшить количество кишечной микробиоты, тем самым изменить сигнатуру интерферона, вызванную бактериями-комменсалами в эпителии легких, и способствовать ранней репликации вируса гриппа в дыхательных путях. Подобный эффект можно обратить вспять с помощью ТФМ [15]. Следовательно, весьма вероятно, что ТФМ может усилить иммунитет и стать потенциальным терапевтическим методом для людей с вирусной инфекцией. Учитывая тот факт, что желудочно-кишечные симптомы и нарушения иммунитета распространены у пациентов с COVID-19, мы предполагаем, что ТФМ может оказать благотворное влияние на микробиоту кишечника, желудочно-кишечные расстройства и иммунную систему после инфекции SARS-CoV-2. В этом пилотном исследовании мы отобрали 11 выписанных пациентов с COVID-19 в марте 2020 года в провинции Цзянси и провели ТФМ, чтобы изучить потенциальное положительное влияние ТФМ на дисбактериоз кишечника и иммунную систему.
Методы
Участники исследования
Данное проспективное интервенционное одноцентровое пилотное исследование ТФМ проводилось в китайском городе Ганьчжоу провинции Цзянси. Местный комитет по этике одобрил исследование (номер разрешения: 2020001), а пациенты предоставили письменное информированное согласие. Всего с момента вспышки заболевания в городе Ганьчжоу было подтверждено 76 случаев COVID-19. В апреле 2020 года мы отобрали 11 пациентов с лабораторно подтвержденным диагнозом COVID-19, которые первоначально были госпитализированы в больницу города Ганьчжоу в период с 26 января по 4 марта 2020 года. Все пациенты были выписаны из больницы в период с 13 февраля по 23 марта 2020 года. График постановки диагноза, выписки и набора пациентов был обобщен на рисунке 1. Все пациенты воздерживались от приема антибиотиков или противовоспалительных препаратов в течение двух недель до лечения.
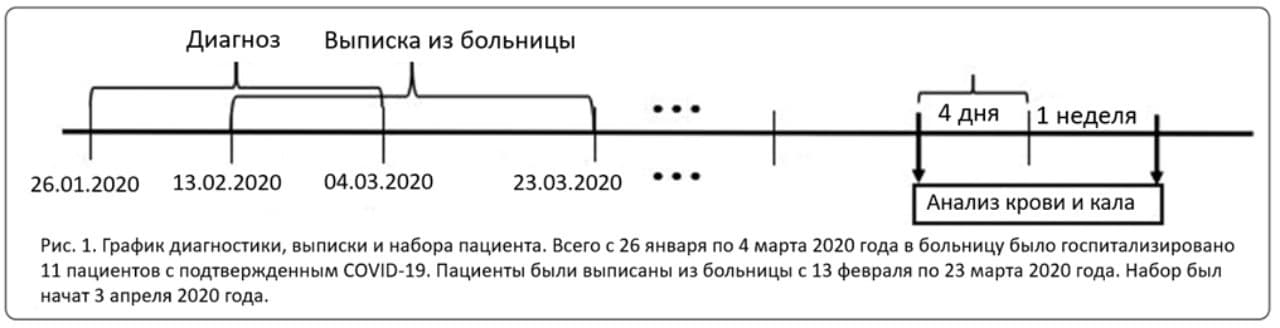
Сбор данных
Общая информация была собрана путем личного опроса и включала возраст, пол, род занятий, место рождения, дату постановки диагноза COVID-19, оценку степени тяжести при поступлении и дату выписки. С помощью анкетирования были получены сведения о симптомах со стороны кишечника, включая запор, диарею, боль в животе, гастралгию, кислотный рефлекс и гастрэктазию, а также данные насчет утомляемости, депрессии, беспокойства и бессонницы.
Результаты лабораторных исследований
Лабораторные данные были собраны и проанализированы до и после ТФМ. Лабораторная диагностика включала ОАК (лейкоциты, нейтрофилы, лимфоциты, тромбоциты, эритроциты, гемоглобин), БХ анализ крови (альбумин, глобулин, АЛТ, АСТ, азот мочевины крови, креатинин сыворотки).
Субпопуляция лимфоцитов
Периферическую кровь забирали в пробирки с ЭДТА для определения субпопуляции лимфоцитов за 1 неделю до и через 1 неделю после ТФМ. Все образцы были протестированы в течение 6 часов после сбора. Вкратце, 69 показателей были измерены с помощью многоцветной проточной цитометрии с использованием сотен человеческих моноклональных антител. Клетки были проанализированы с помощью системы проточной цитометрии BDFACS Canto II (BD Biosciences). В конечном счете данные по субпопуляции лимфоцитов были представлены в виде процентного содержания.
ТФМ лечение
Протоколы донорского скрининга, приготовление капсул для ТФМ и схемы лечения были стандартизованы. Пациенты принимали пероральные капсулы с фекальной микробиотой в контролируемых клинических условиях. Участники получали 10 капсул каждый день в 4 дня подряд. Все капсулы готовились от одного донора микробиоты. Во время ТФМ происходил мониторинг возможных побочных реакций: лихорадки, головной боли и желудочно-кишечных симптомов, таких как диарея, тошнота, рвота, вздутие живота и боль в животе.
Оценка микробиома кишечника с помощью cеквенирования гена 16S рРНК (16s sequencing)
NB! Примечание – не путать микробиом и микробиоту! Микробиом - совокупность генов микроорганизмов в организме человека, то есть коллективный геном микробиоты. Микробиота — это совокупность микроорганизмов в определенной экосистеме, в частности, в организме человека).
Образцы кала пациентов были собраны за неделю до и через неделю после ТФМ. Участникам раздали пакеты для отбора проб, образцы фекалий были собраны и сохранены в запечатанном контейнере, который транспортировался вместе с пакетами с замороженным гелем, чтобы обеспечить низкотемпературную среду до доставки в лабораторию. Образцы фекалий были предварительно обработаны, а микробиом кишечника охарактеризован с помощью секвенирования 16S рРНК. Секвенирование генов микробиоты было выполнено с использованием QIIME2, а база данных Silva использовалась для таксономической идентификации бактерий.
Полученные результаты
Основная информация об 11 пациентах с COVID‑19, получавших пероральную инкапсулированную ТФМ
В исследовании участвовали 11 пациентов с COVID-19, которые были вылечены и выписаны из больницы (таблица 1). Средний возраст составлял 49 лет, 6 пациентов были мужчинами. При поступлении 10 участников были отнесены к категории «нетяжелых»: отсутствовали рентгенологические свидетельства пневмонии или пневмония наряду с лихорадкой и респираторными симптомами были без явного изменения сатурации или дыхательной недостаточности, требующей искусственной вентиляции легких (ИВЛ), шока или полиорганной недостаточности, требующих интенсивной терапии. Один участник был отнесен к категории тяжелых, поскольку страдал от шока и нуждался в интенсивной терапии.
Желудочно-кишечные симптомы и результаты лабораторных исследований до и после ТФМ
В общей сложности 5 из 11 выписанных пациентов имели желудочно-кишечные симптомы в той или иной степени, включая запор, диарею, боль в животе, гастралгию, кислотный рефлекс и гастрэктазию (таблица 1). Симптомы со стороны ЖКТ присутствовали при поступлении и сохранялись после выписки. Ни один пациент не сообщал о ЖК-симптомах до начала заболевания. После ТФМ 5 пациентов сообщили об облегчении желудочно-кишечных симптомов. Большинство лабораторных результатов, включая ОАК и БХ крови, были в пределах нормы у выписанных пациентов с COVID-19. У 8 из 11 (72,7%) испытуемых было незначительное снижение соотношения альбумин/глобулин, которое не показало очевидного улучшения после ТФМ.
|
Таблица 1. Симптомы 11 пациентов с COVID-19 до и после ТФМ |
||
|
Симптомы |
Частота симптомов до ТФМ (%) |
Уменьшение симптомов после ТФМ (%) |
|
Запор |
3 (27,3%) |
3 (27,3%) |
|
Диарея |
1 (9,1%) |
1 (9,1%) |
|
Боль в животе |
1 (9,1%) |
1 (9,1%) |
|
Гастралгия |
1 (9,1%) |
1 (9,1%) |
|
Кислотный рефлекс |
2 (18,2 %) |
1 (9,1%) |
|
Гастректазия |
1 (9,1%) |
1 (9,1%) |
|
Симптомы со стороны ЖКТ (всего) |
5 (45,5%) |
5 (45,5%) |
|
Усталость |
3 (27,3%) |
2 (18,2%) |
|
Депрессия и тревога |
2 ( 18,2%) |
1 (9,1%) |
|
Бессонница |
3 (27,3%) |
3 (27,3%) |
|
Психологические симптомы (всего) |
5 (45,5%) |
4 (36,4%) |
Изменение субпопуляции периферических лимфоцитов после ТФМ
В дополнение к стандартному анализу крови проанализировали состав субпопуляций лимфоцитов с помощью цитометрии. Мы получили подробную информацию об экспрессии 69 различных типов лимфоцитов, причем все лимфоциты были разделены на пять основных подгрупп: CD4+ Т-клетки (n = 17), CD8+ Т-клетки (n = 18), γδT-клетки (n = 12), B-клетки (n = 12) и NK-клетки (n = 10). ТФМ оказывает значительное влияние на B-лимфоциты, которое характеризовалось уменьшением наивных B-клеток, увеличением B-клеток памяти и непереключаемых B-клеток. Кроме того, доля дважды положительных Т-клеток увеличивалась после ТФМ (таблица 2).
|
Таблица 2. Доля субпопуляций лимфоцитов, которые достоверно изменились до и после ТФМ |
||||
|
Клетки |
До ТФМ |
После ТФМ |
% |
P-значение |
|
Двойные положительные Т-клетки |
0.8 (0.5 - 3.5) |
1.1 (0.7 - 2.9) |
% Т-клеток |
0.012 |
|
Все B-клетки |
10.9 (7.6 - 14.0) |
8.3 (3.7 - 11.5) |
% лимфоцитов |
0.012 |
|
Наивные В-клетки |
62.2 (54.3 - 69.1) |
40.8 (32.8 - 65.2) |
% B-клеток |
0.012 |
|
В-клетки памяти |
25.3 (20.2 - 30.8) |
37.4 (26.3 - 48.2) |
% B-клеток |
0.001 |
|
Непереключенные B-клетки |
10.2 (7.8 -15.2) |
21.9 (13.7 - 26.0) |
% B-клеток |
0.012 |
Изменения микробиоты кишечника после ТФМ
В 22 образцах фекалий было получено 970 334 ридов (риды — короткие фрагменты ДНК длиной от 25 до 20 000 нуклеотидов, считываемые с генома, т.е. непосредственный результат секвенирования) и, в среднем, для каждого образца было идентифицировано 213 ОТЕ (Оперативная Таксономическая Единица). Богатство микробного сообщества, которое можно оценить с помощью числа ОТЕ, количества наблюдаемых видов и индекса Chao1, незначительно увеличилось после ТФМ, тогда как альфа-разнообразие, оцененное с помощью индекса Шеннона и Симпсона, не показало значительных изменений после ТФМ (Таблица 3).
|
Таблица 3. Богатство и разнообразие кишечной микробиоты |
|||
|
|
До ТФМ |
После ТФМ |
P-значение |
|
Число ОТЕ |
178 (148 - 262) |
226 (205 - 258) |
0.101 |
|
Наблюдаемые виды |
170 (139 - 248) |
218 (194 - 246) |
0.100 |
|
Индекс Chao1 |
225 (182 - 305) |
293 (257 - 327) |
0.060 |
|
Индекс Shannon |
3.78 (3.19 - 4.38) |
3.41 (3.05 - 24.43) |
0.800 |
|
Индекс Simpson |
0.85 (0.80 - 0.88) |
0.7946 (0.72 - 0.89) |
0.904 |
Изменение бактерий по типам. Относительное количество Proteobacteria снизилось, в то время как Actinobacteria увеличилось после вмешательства (P <0,001) (рис. 2). В частности, пациент № 1, у которого был умеренный запор, хорошо купированный после ТФМ, характеризовался высокой долей Firmicutes (67,8%) и Fusobacteria (22,7%) и отсутствием Bacteroidetes (3,7%). ТФМ значительно увеличила количество Bacteroidetes (62,6%), уменьшила количество Firmicutes (26,0%) и Fusobacteria (9,2%). Пациент № 7 тяжело переносил COVID-19 и страдал от диареи. У пациента был представлен профиль микробиома с чрезвычайно высоким содержанием Bacteroidetes (84,4%) и низким относительным содержанием Firmicutes (12,3%). После ТФМ доля Bacteroidetes снизилась (45,7%), а доля Firmicutes увеличилась (48,7%). Пациент № 11 страдал от тяжелого запора, в профиле кишечной микробиоты у него была высокая доля актинобактерий (28,6%) и протеобактерий (37,2%), тогда как количество бактерий Bacteroidetes было низким (0,2%). После ТФМ наблюдалось значительное снижение численности Proteobacteria (2,5%).
Изменение бактерий по родам. 5 главных родов до ТФМ:
- Bacteroides (28,3%)
- Prevotella (13,0%)
- Faecalibacterium (6,5%)
- Lachnospiraceae (6,2%)
- Phascolarctobacterium (5,7%).
После ТФМ в пятерку главных родов входили:
- Bacteroides (31,1%)
- Faecalibacterium (11,7%)
- Prevotella (6,6%)
- Bifdobacterium (10,4%)
- Collinsella (4,5%) (рис. 2).
Bifidobacterium, Faecalibacterium, Collinsella значительно увеличились после ТФМ.
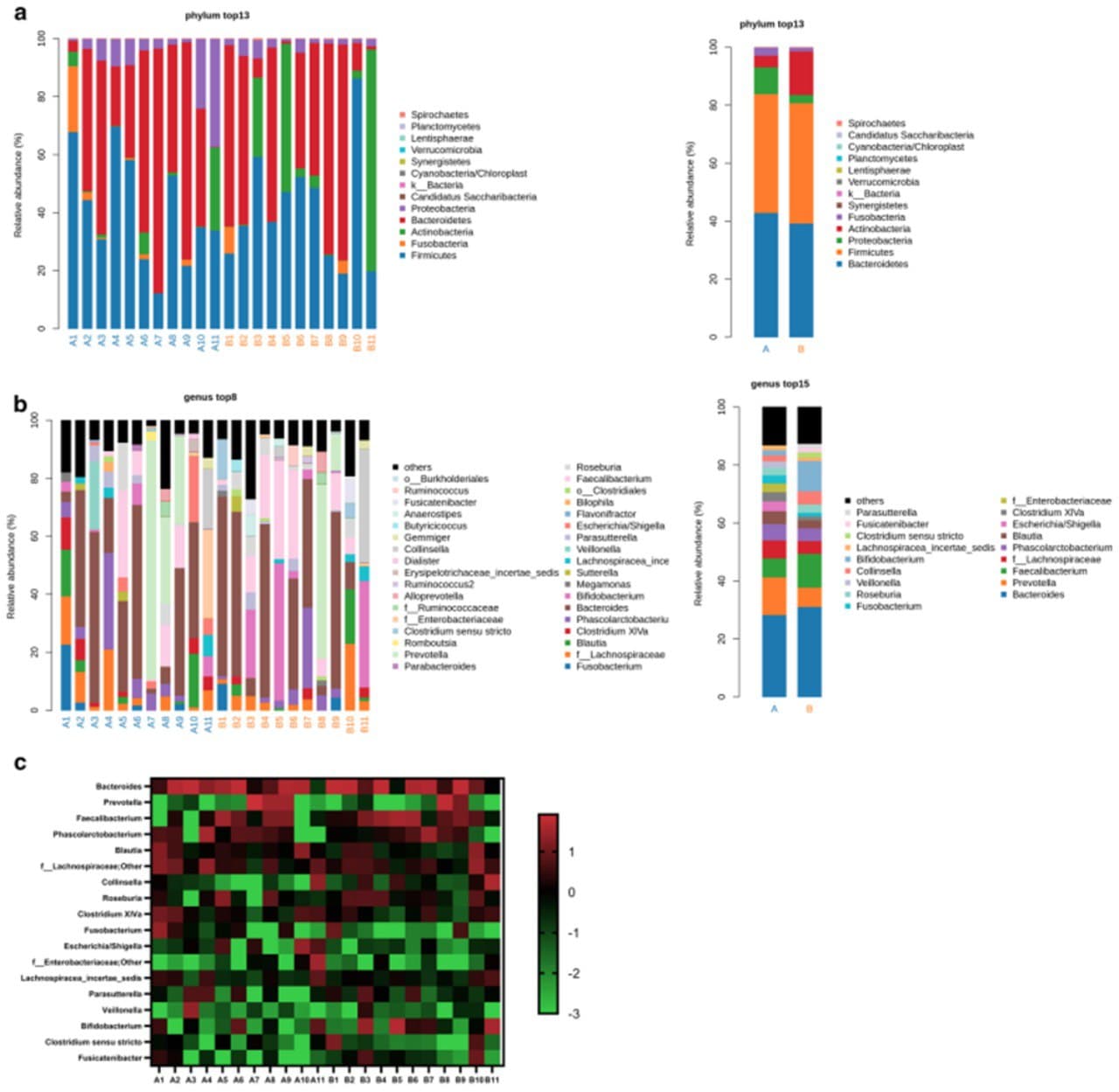
Рисунок 2. Изменения микробиоты кишечника у выписанных пациентов с COVID-19 после ТФМ. Изменения микробиоты кишечника были представлены на уровне типов и родов. а) Были представлены изменения относительной численности индивидуального филума (в %) как для отдельных пациентов, так и на среднем уровне. b) Представлены изменения относительной численности отдельных родов как для индивидуальных пациентов, так и на среднем уровне. c) Тепловая карта изменений относительной численности 15 ведущих родов. Примечание: A # - до ТФМ, B # - после ТФМ.
Пациент № 1 характеризовался высокой долей Fusobacterium (22,7%), Lachnospiraceae (16,6%), Blautia (16,1%), Clostridium XLVa (11,1%). После ТФМ количество Bacteroides (61,9%) увеличилось, тогда как доли Blautia (0,25%), ClostridiumXlVa (1,0%), Lachnospiraceae (1,6%), Fusobacterium (9,2%) снизились. У пациента № 7 с тяжелой формой COVID-19 была высокая доля Prevotella (82,5%), которая снизилась (0,01%), в то время как Bacteroides (44,4%) и Phascolarctobacterium (27,8%) увеличились после ТФМ. Пациент № 11 имел высокую долю Enterobacteriaceae (30,7%) и Collinsella (20,9%). После ТФМ относительное количество Enterobacteriaceae снизилось (1,2%), тогда как Bifidobacterium значительно увеличилось (36,7%).
Во время ТФМ наблюдались побочные елудочно-кишечные эффекты, такие как диарея и боль в животе.
Обсуждение
При наблюдении за вылеченными от COVID-19 и выписанными из больницы пациентами мы обнаружили, что у них имеют место желудочно-кишечные нарушения и психологические расстройства, ослабленный иммунитет и дисбактериоз кишечника. После ТФМ наблюдалось изменение субпопуляции периферических лимфоцитов, восстановление кишечной микробиоты и облегчение желудочно-кишечных расстройств.
Ранние отчеты показали, что у 2–15% пациентов, инфицированных SARS-CoV-2, наблюдались симптомы диареи, а в 1–5% случаев - тошнота и рвота. Недавно Cheung et al. опубликовали метаанализ, в котором сообщается, что до 20% пациентов имеют симптомы со стороны ЖКТ [3, 4, 16–18]. Примерно у 50% пациентов с COVID-19 образцы кала были SARS-CoV-2-положительными, что позволяет предположить, что пищеварительный тракт может быть еще одним местом репликации и активности вируса [19, 20]. Даже у выписанных пациентов с COVID-19 нередки такие проблемы, как желудочно-кишечные расстройства. Однако эти нарушения в значительной степени недооцениваются и игнорируются. В связи с быстро растущим числом выздоровевших пациентов все больше и больше внимания будет уделяться состоянию их здоровья после перенесенного COVID-19.
Уже давно было отмечено, что респираторные вирусные инфекции могут приводить к изменениям микробиома кишечника, а нарушение микробиома кишечника предрасполагает ко вторичным бактериальным инфекциям [21, 22]. АПФ-2 является ключевым рецептором, который способствует проникновению коронавируса в организм хозяина. АПФ-2 экспрессируется не только в дыхательных путях, но также в высокой степени экспрессируется в ЖКТ [23, 24], что может частично объяснять желудочно-кишечные симптомы у пациентов с COVID-19.
Прямые доказательства связи COVID-19 с микробиотой кишечника были представлены Siew и соавторами –у госпитализированных пациентов, больных COVID-19, наблюдались стойкие изменения микробиома кала. Изменения фекальной микробиоты были положительно связаны с фекальной вирусной нагрузкой SARS-CoV-2 и тяжестью заболевания COVID-19 [9]. В нашей работе уровне типа относительная численность Firmicutes, Bacteroidetes, Actinobacteria, Proteobacteria составляла 41,0%, 42,9%, 9,2%, 4,0% соответственно, что отличалось от численности нормальной популяции кишечной микробиоты. В здоровой популяции преобладающими типами являются Firmicutes и Bacteroidetes с относительной численностью около 60% и 20% соответственно [25–26].
Siew и соавторы сообщили в своем исследовании, что воздействие на кишечную микробиоту может снизить тяжесть COVID-19 [9]. Фактически, в начале февраля 2020 года Национальная комиссия здравоохранения Китая в 5-м издании руководства рекомендовала использовать пробиотики для поддержания микроэкологического баланса кишечника и предотвращения вторичной бактериальной инфекции при лечении пациентов с тяжелой инфекцией COVID-19. Мы также исследуем, может ли ТФМ быть эффективной стратегией уменьшения остаточных явлений COVID-19 путем изменения микробиома кишечника. Мы наблюдали изменение микробиома кишечника и облегчение симптомов после ТФМ, особенно у пациентов с тяжелыми желудочно-кишечными симптомами. Мы также наблюдали, что общее распределение 69 различных типов лимфоцитов различается между «до ТФМ» и «после ТФМ», особенно для субпопуляции B-лимфоцитов. Вероятно, нацеливание на микробиоту кишечника с помощью ТФМ оказывает благоприятное влияние на систему иммунитета после инфекции SARS-CoV-2. ТФМ может служить потенциальным терапевтическим и реабилитационным средством при COVID-19.





