Синдром перекрёста аутоиммунного гепатита и первичного склерозирующего холангита, ассоциированных с гиперэозинофилией
Аутоиммунный гепатит, первичный склерозирующий холангит и гиперэозинофилия у одного пациента
По материалам: Hatami, B., Rahmani Seraji, H. & fallahi, M. Atypical presentation of autoimmune hepatitis–primary sclerosing cholangitis overlap syndrome associated with hypereosinophilia: a case report and review of the literature. J Med Case Reports 15, 524 (2021). https://doi.org/10.1186/s13256-021-03086-9
Синдром перекрёста аутоммунного гепатита и первичного склерозирующего холангита (АИГ-ПСХ) проявляется клинически, биохимически, иммунологически и гистологически гепатитом с холангиографическими аномалиями, характерными для ПСХ [1]. Частота синдрома колеблется от 1% до 6% всех случаев АИГ [2] и чаще встречается у мужчин, чем у женщин [1]. АИГ или ПСХ в сочетании с гиперэозинофилией периферической крови (ГЭ) - это редкое заболевание, описанное как серия случаев [3,4,5], но, насколько нам известно, о гиперэозинофилии периферической крови в сочетании с синдромом перекреста АИГ-ПСХ еще не сообщалось.
33-летний мужчина (Иран) был направлен в больницу по поводу лихорадки, зуда, желтухи, повышенной утомляемости, темной мочи и обесцвеченного стула на протяжении трех месяцев. У него не было в анамнезе аллергических реакций, желудочно-кишечных, печеночных, гематологических или инфекционных заболеваний. Лекарств не принимал, жил один и не имел сексуальных контактов, сопряженных с повышенным риском. Наследственность не отягощена. Физикально: склеры желтушны, кожных повреждений, гепатоспленомегалии, лимфаденопатии и асцита не выявлено.
Данные лабораторной диагностики указывали на гиперэозинофилию и гепатоцеллюлярное поражения печени:
- АЛТ 710 МЕ /л (норма 10-40);
- АСТ 389 МЕ/л (5-40);
- ЩФ 677 МЕ/л (40-130);
- ГГТП 167 Е/л (8–61);
- Общий билирубин 3,45 мг/дл (0,3–1,2);
- Прямой билирубин 2,79 мг/дл (0–0,3);
- Протромбиновое время 12,6 секунды;
- Международное нормализованное отношение (МНО) 1,27 (0,8–1,2).
ОАК:
- Лейкоциты 15 630 / мм3
- Гемоглобин 155 г /л;
- Тромбоциты 152 000 / мм3
- Эозинофилы 53%, с абсолютным числом эозинофилов 8283/мм3.
Уровень IgG в сыворотке крови составлял 2200 мг/дл (700–1400 мг / дл).
Уровень сывороточного IgG4 был нормальным, а иммуноэлектрофорез сывороточного белка выявили поликлональную гаммопатию. Инфекционные заболевания были исключены по отрицательным результатам на ВИЧ и маркеры вирусных гепатитов (А, В и С). Сывороточные антитела к паразитам, серологический тест на печёночную двуустку (Fasciola hepatica) и исследования кала на паразитов и простейших были отрицательными.
Кроме того, исследование на аутоиммунный гепатит [антинуклеарные антитела (ANA), антитела гладкой мускулатуры (SMA), микросомальные антитела против печени почек 1 типа (анти-LKM-антитело 1) и антимитохондриальные антитела (AMA)] были отрицательными.
Эозинофилия, связанная с миелопролиферативными заболеваниями, была исключена на основании отрицательных генетических тестов на связанные мутации. Биопсия костного мозга показала нормальное кроветворение с повышенным содержанием морфологически нормальных эозинофилов (на их долю приходилось 30% всех ядерных клеток в костном мозге). Проточная цитометрия также была нормальной.
УЗИ и КТ брюшной полости и грудной клетки без особенностей. Колоноскопия пациента прошла нормально. MР-холангиопанкреатография (МРХПГ, рис. 1) показала неравномерность стенок общего печеночного протока и общего желчного протока с множественными сужениями. Также были замечены мелкие неровности внутрипеченочных желчных протоков с множественными стриктурами, «бусинками» и некоторыми выступающими лимфатическими узлами в воротах печени размером до 32×13 мм.
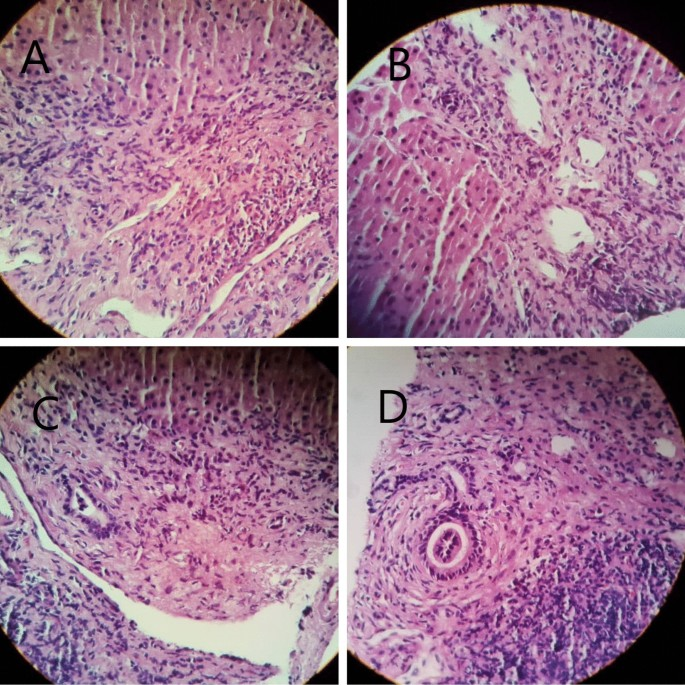
Биопсия печени выявила умеренную лимфоцитарную инфильтрацию: скопление плазматических клеток и эозинофилов в портальной области, что привело к перипортальному гепатиту и множественному очаговому и сливному некрозу.
Разрастания желчных протоков не наблюдалось. Отмечен умеренный фиброз вокруг желчных протоков по типу луковой шелухи без признаков холестаза и стеатоза (рис. 2).
Рисунок 1 Результаты МР-холангиопанкреатографии (МРХПГ). Множественные стриктуры желчевыводящих путей.
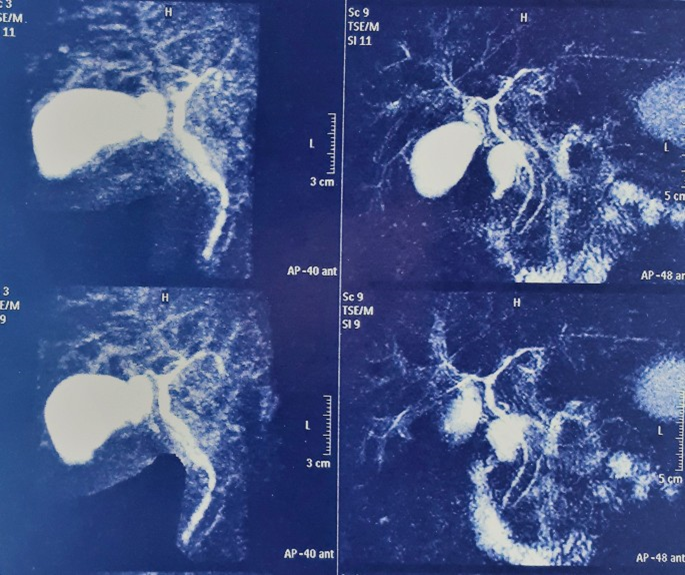
Рисунок 2 Биопсия печени: умеренная инфильтрация лимфоцитами, плазматическими клетками и эозинофилами в портальной области, ведущую к перипортальному гепатиту (A – C). Инфильтрация эозинофилов (A) и инфильтрация лимфоцитов и плазматических клеток в портальной области (B, C). Умеренный фиброз вокруг желчных протоков по типу луковой шелухи без признаков холестаза и стеатоза (D)
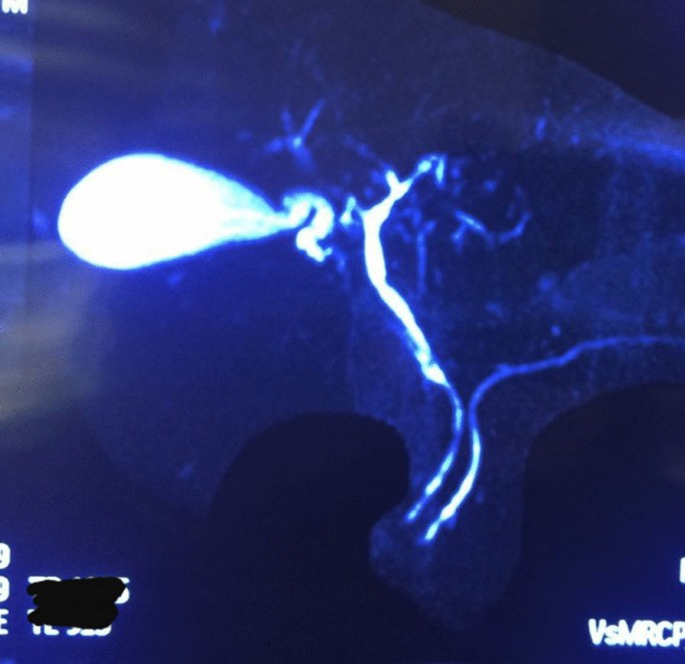
По результатам диагностического поиска пациенту поставлен диагноз синдрома перекреста АИГ-ПСХ и начато лечение преднизолоном (30 мг один раз в день), азатиоприном (50 мг один раз в день) и урсодезоксихолевой кислотой (УДХК) (300 мг три раза в день). Дозу преднизолона в течение 2 месяцев постепенно снижали до 5 мг. Желтуха и эозинофилия разрешились через 2 недели: пациент стал полностью бессимптомным. В таблице 1 представлены лабораторные данные пациента на момент постановки диагноза, а также через 1, 6 и 12 месяцев после начала лечения. МРХПГ пациента через 6 месяцев показала стриктуры ЖВП без дилатации (рис. 3).
Таблица 1 Лабораторные данные пациента на момент постановки диагноза и через 1, 6 и 12 месяцев после начала лечения
|
Лабораторные данные |
При диагностике |
1 месяц |
6 месяцев |
12 месяцев после постановки диагноза |
|
Общий билирубин (мг/дл) |
3,45 |
1.2 |
1.01 |
1.01 |
|
Прямой билирубин (мг/ дл) |
2,79 |
0,2 |
0,2 |
0,2 |
|
АСТ (МЕ/л) |
710 |
35 |
30 |
30 |
|
АЛТ (МЕ/л) |
389 |
20 |
25 |
20 |
|
ЩФ (МЕ/л) |
677 |
100 |
67 |
65 |
|
GGT (Ед/л) |
167 |
54 |
60 |
60 |
|
Лейкоциты (на мм3) |
15 630 |
7000 |
5500 |
5000 |
|
Абсолютное количество эозинофилов (на мм3) |
8283 |
150 |
100 |
125 |
Рис. 3 Повторная МРХПГ пациента через 6 месяцев
Обсуждение
Синдром перекрести АИГ-ПСХ характеризуется гепатитом и изменениями желчнывыводящих путей на МРХПГ или ЭРХПГ при отрицательных АТ к митохондриям [6, 7]. Эозинофилия редко сопутствует АИГ и ПСХ [8, 9], а случаи эозинофилии при перекресте данных патологий не описаны, по крайней мере в англоязычной медицинской литературе. В приведенном случае АИГ-ПСХ был поставлен на основании смешанного паттерна повышенных ферментов печени, гипергаммаглобулинемии, характерной картины внутри- и внепеченочного билиарного дерева при МРХПГ и выраженного перипортального гепатита по данным гистологии печени. Дифференциальную диагностику проводили с поражением печени на фоне гиперэозинофильного синдрома.
Гиперэозинофилия (ГЭ) в периферической крови определяется как абсолютное количество эозинофилов > 1,5×109 /л (или> 1500 клеток/мкл) при двух исследованиях, разделенных во времени не менее чем на месяц. Гиперэозинофильный синдром (ГЭС) определяется ассоциацией ГЭ с опосредованным эозинофилами повреждением и/или дисфункцией органа [10]. ГЭС подразделяется на три типа:
- первичный (или неопластический): эозинофилы являются частью неопластического клона (миелоидные или эозинофильные опухоли). В приведенном случае был исключен согласно лабораторным данным и результатам биопсии костного мозга;
- вторичный (или реактивный) был исключен на основании отрицательных результатов исследований на паразитов, отсутствия аллергоанамнеза и истории медикаментозного лечения;
- идиопатический при котором основная причина остается неизвестной, несмотря на тщательное исследование. Последний тип ГЭС не может быть исключен для нашего пациента.
Kawamura и коллеги приводят данные о повреждении печени на фоне ГЭ в десяти случаях активного гепатита. У всех этих пациентов при биопсии печени выявляли портальное воспаление и инфильтрацию эозинофилами в этой области [11], аналогично результатам биопсии печени у нашего пациента. С другой стороны, наличие рисунка по типу луковой шелухи – наиболее специфическая гистологическая находкой при ПСХ, противоречит диагнозу ГЭС. ПСХ с ГЭ и эозинофильная холангиопатия – это две разные сущности; иногда их трудно различить, и большинство клинических данных о них получено из отчетов о единичных случаях [12]. Ichikawa и коллеги представили случай сочетанных ГЭ и ПСХ, диагноз был поставлен в соответствии с изменениями желчных протоков при ЭРХПГ, терапию проводили преднизолоном и УДХК. Наблюдался быстрый ответ на преднизолон, и через 2 месяца все симптомы разрешились [13]. В случаях, описанных Grauer [8] и Schoonbroodt [9] с коллегами также установлено уменьшение поражения желчных протоков при повторной ЭРХПГ после лечения.
Столь резкий положительный ответ на кортикостероиды может указывать на то, что поражение желчных протоков у этих пациентов было связано с эозинофилией. В нашем случае симптомы (лихорадка, зуд, желтуха, усталость, темная моча и обесцвеченный стул), ферменты печени и ГЭ быстро улучшились после начала лечения преднизолоном, азатиоприном и УДХК. Это может указывать на то, что ГЭ участвует в патогенезе заболевания, хотя оставшиеся изменения желчных протоков при повторном МРХПГ противоречит этому. Таким образом, мы описали случай синдрома перекрёста АИГ-ПСХ, связанного с ГЭ, при котором эозинофилы могут вносить вклад в клинические проявления и осложнения заболевания.
Обсудить последние новости со всеми коллегами России вы можете в чатах:
- WhatsApp:
- Telegram:
- ВКонтакте:
Список литературы:
- Nayagam JS, Miquel R, Joshi D. Overlap syndrome with autoimmune hepatitis and primary sclerosing cholangitis. EMJ Hepatol. 2019;7(1):95–104.
- Bairy I, et al. Autoimmune hepatitis—primary biliary cirrhosis overlap syndrome. J Clin Diagn Res. 2017;11(7):07–9.
- Kaya M, Angulo P, Lindor KD. Overlap of autoimmune hepatitis and primary sclerosing cholangitis: an evaluation of a modified scoring system. J Hepatol. 2000;33:537.
- van Buuren HR, van Hoogstraten HJE, Terkivatan T, et al. High prevalence of autoimmune hepatitis among patients with primary sclerosing cholangitis. J Hepatol. 2000;33:543.
- Gohlke F, Lohse AW, Dienes HP, et al. Evidence for an overlap syndrome of autoimmune hepatitis and primary sclerosing cholangitis. J Hepatol. 1996;24:699.
- McNair AN, Moloney M, Portmann BC, et al. Autoimmune hepatitis overlapping with primary sclerosing cholangitis in five cases. Am J Gastroenterol. 1998;93:777.
- Gregorio GV, Portmann B, Karani J, et al. Autoimmune hepatitis/sclerosing cholangitis overlap syndrome in childhood: a 16-year prospective study. Hepatology. 2001;33:544.
- Horiuchi K, et al. Marked eosinophilia as the first manifestation of sclerosing cholangitis. Intern Med. 2009;48:1377–82.
- Chowdry S, Rubin E, Sass DA. Acute autoimmune hepatitis presenting with peripheral blood eosinophilia. Ann Hepatol. 2012;11:559–63.
- Kawamura T, et al. A possible case of hepatitis due to hypereosinophilic syndrome. Intern Med. 2016;55:1453–8.
- Perdigoto R, Carpenter HA, Czaja AJ. Frequency and significance of chronic ulcerative colitis in severe corticosteroid-treated autoimmune hepatitis. J Hepatol. 1992;14:325.
- Fauci AS, Harley JD, Roberts WC, Ferrans VJ, Gralnick HR, Bjornson HB. The idiopathic hypereosinophilic syndrome. Clinical, pathophysiologic and therapeutic consideration. Ann Intern Med. 1982;97:78–92.
- Ichikawa N, et al. Sclerosing cholangitis associated with hypereosinophilic syndrome. Intern Med. 1997;36:561–4.





