Скрытая причина острого поражения почек: клинический случай
Скрытая причина поражения почек: клинический случай
78-летний мужчина европеоидной расы с болезнью Альцгеймера поступил в отделение неотложной помощи с уровнем креатинина в сыворотке 6,52 мг/дл по сравнению с исходным значением 1,9 мг/дл за 3 месяца до обращения. В анамнезе — доброкачественная гипертрофия предстательной железы с остаточной мочой в мочевом пузыре, поэтому был установлен катетер Фолея, чтобы исключить обструктивную уропатию. Пациент также ранее страдал левосторонним гидронефрозом: нефролитиаз, который возник из-за отложений оксалата кальция. Проведена литотрипсия. Прикроватное УЗИ почек, проведенное в отделении неотложной помощи, не выявило ни камней, ни гидронефроза.
По словам его жены, у пациента был плохой аппетит, но он пил жидкости в достаточном количестве. АД контролировалось дома, и сообщений о гипотонии не было. Эпизодов тошноты, рвоты или диареи не было. Нестероидные противовоспалительные препараты не принимал, и новые препараты в последнее время не добавлялись. У мужчины не было симптомов мальабсорбции и операций на желудочно-кишечном тракте, также как и семейной истории болезни почек или камней в почках.
Физикальное обследование — без особенностей. По лабораторным данным при поступлении концентрация креатинина в сыворотке пациента составила 6,52 мг/дл, что соответствует расчетной скорости клубочковой фильтрации (СКФ) 7 мл/мин/1,73 м2 при исходном уровне 34 мл/мин/1,73 м2. (Таблица 1). Анализ мочи показал мутную желтую мочу с редкими бактериями и умеренно повышенной протеинурией (100 мг/дл). Пациент был госпитализирован для дальнейшего обследования и лечения ОПП при ХБП (хронической болезни почек). Серологическое исследование не выявило аутоиммунного характера поражения почек. Кроме того, электрофорез мочи и сыворотки не выявил моноклональной гаммапатии. Чтобы избежать дальнейшей кальциевой нагрузки, прием ацетата кальция был прекращен, и пациенту была начата инфузионная терапия и пероральный прием севеламера карбоната в дозе 800 мг с каждым приемом пищи при гиперфосфатемии.
Таблица 1. Базовая метаболическая панель и общий анализ крови в день поступления
| Показатель | Результат | Единицы | |
| Натрий | 129 | мг-экв/л | Низкий |
| Калий | 4.4 | мг-экв/л | |
| Хлорид | 97 | мг-экв/л | |
| Бикарбонат | 21 | мг-экв/л | |
| Азот мочевины крови | 55 | мг/дл | |
| Креатинин | 6.52 | мг/дл | Высокий |
| Расчётная СКФ | 7 | мл/мин/1,73 м<2 | Низкий |
| Глюкоза, случайное определение | 144 | мг/дл | Высокий |
| Кальций | 8.2 | мг/дл | Низкий |
| Фосфор | 5.5 | мг/дл | Высокий |
| Альбумин | 3.6 | г/дл | |
| Креатинкиназа | 144 | ед/л | |
| Гемоглобин | 103 | г/л | Низкий |
| Гематокрит | 30.1 | % | |
| Лейкоциты | 6.5 | 10<9 | |
| Тромбоциты | 161 | 10<9 |
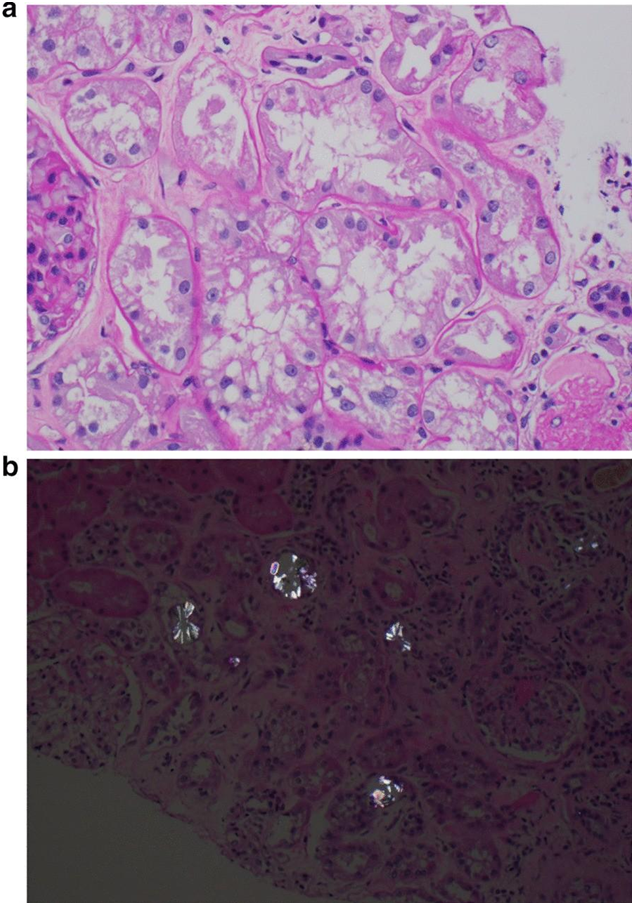
Чтобы понять генез ОПП у пациента, была выполнена биопсия левой почки. Световая микроскопия показала многочисленные внутриканальцевые кристаллы, соответствующие оксалату кальция, отложения были ассоциированные с очаговым отеком, повреждением канальцев и интерстициальным воспалением. Тубулярная атрофия и интерстициальный фиброз охватили 50% коры, а 8 из 26 клубочков имели очаговый перигломерулярный фиброз (рис. 1а, b). Иммунофлюоресцентное исследование выявило депозиты альбумина, иммуноглобулин G, легких цепей каппа и лямбда на мембранах канальцев и клубочков. При электронной микроскопии зафиксировано неравномерное утолщение базальной мембраны клубочков, что соответствует ишемическим изменениям. Также была отмечена утрата щеточной каймы.Диагностировано острое повреждение канальцев с обширным отложением кристаллов оксалата кальция.
Рисунок 1.
а. Окрашивание периодической кислотой Шиффа (PAS) с увеличением в 400 раз — острое повреждение канальцев.
b. Окрашивание гематоксилин-эозином, увеличение в 200 раз — кристаллы оксалата в поляризованном свете.
После результатов биопсии врачи дополнительно расспросили семью о диете пациента. Выяснилось, что за несколько недель до болезни он начал есть огромное количество листовых зеленых овощей. Пациент не знал об избыточном уровне оксалатов, присутствующих в его рационе. Это могло быть причиной острой оксалатной нефропатии, учитывая отсутствие других объяснений ухудшения функции почек.
Для справки: Оксалат — это простая дикарбоновая кислота, часто встречающаяся в различных растениях и листовых овощах [1]. Он вырабатывается экзогенно при употреблении продуктов, богатых оксалатами, или эндогенно при распаде аскорбиновой кислоты и аминокислот [2]. Основными диетическими источниками оксалатов являются листовые зеленые овощи (например, шпинат), шоколад, ревень, свекла, листовая свекла, чай, орехи и пшеничные отруби [3]. Экскреция оксалатов происходит с мочой в неизмененном виде из-за незначительного метаболизма в организме человека [1]. Наличие избытка оксалатов в моче может привести к развитию нефрокальциноза, нефролитиаза или оксалатной нефропатии [4].
Терапия
Пациенту рекомендовано увеличить объем потребляемой жидкости и избегать любых нефротоксических агентов (внутривенное введение контрастного вещества, аминогликозиды и нестероидные противовоспалительные препараты). Его также поддерживали инфузионной терапией. Однако, несмотря на медикаментозное лечение, функция почек пациента продолжала ухудшаться. Поэтому было принято решение о начале гемодиализа.
В Таблице 2 описаны тесты функции почек пациента. Начало гемодиализа на 5-е сутки после поступления привело к улучшению показателей. Затем проводили гемодиализ в течение некоторого времени для проверки любых признаков восстановления функции почек. Однако функция почек у пациента продолжала ухудшаться, поэтому было принято решение оставить его на хроническом гемодиализе.
Таблица 2. Динамика панели функции почек
| Показатель | Результат | Единицы | |
| Натрий | 129 | мг-экв/л | Низкий |
| Калий | 4.4 | мг-экв/л | |
| Хлорид | 97 | ||
| Бикарбонат | 21 | мг-экв/л | |
| Азот мочевины крови | 55 | мг/дл | |
| Креатинин | 6.52 | мг/дл | Высокий |
| Расчётная СКФ | 7 | мл/мин/1,73 м2 | Низкий |
| Глюкоза, случайное определение | 144 | мг/дл | Высокий |
| Кальций | 8.2 | мг/дл | Низкий |
| Фосфор | 5.5 | мг/дл | Высокий |
| Альбумин | 3.6 | г/дл | |
| Креатинкиназа | 144 | ед/л | |
| Гемоглобин | 103 | г/л | Низкий |
| Гематокрит | 30.1 | % | |
| Лейкоциты | 6.5 | 109/л | |
| Тромбоциты | 161 | 109/л |
Обсуждение
Причины гипероксалурии могут быть первичными или вторичными. Первичная гипероксалурия представляет собой группу редких аутосомно-рецессивных (АР) нарушений метаболизма глиоксилата, приводящих к перепроизводству оксалатов.
Первичная гипероксалурия типа 1, наиболее тяжелая форма, вызвана дефицитом фермента аланин-глиоксилат аминотрансферазы (AGXT), специфичного для печени пероксисомального и ответственного за трансаминирование глиоксилата в глицин.
Первичная гипероксалурия типа 2, менее тяжелая форма, вызвана дефицитом глиоксилат редуктазы-гидроксипируватредуктазы (GRHPR), преимущественно внутрипеченочный фермент, ответственный за восстановление глиоксилата до и гидроксипирувата до D -глицерата.
Первичная гипероксалурия 3 типа, наименее тяжелая форма, вызвана дефицитом 4-гидрокси-2-оксоглутарат альдолазы (HOGA), специфичного для печени митохондриального фермента, ответственного за метаболизм гидроксипролина [5, 6].
Первичная гипероксалурия может возникнуть практически в любом возрасте, от рождения до шестого десятилетия жизни [5]. Однако средний возраст начала заболевания составляет 5,5 лет [7]. Клинические проявления варьируют от нефрокальциноза в младенчестве до случайного камнеобразования во взрослом возрасте, и диагноз устанавливается с помощью генетического тестирования [5].
Поддерживающее лечение включает увеличение потребления жидкости, снижение содержания оксалатов в рационе, подщелачивание мочи и прием препаратов, связывающих кальций, которые уменьшают осаждение камней из оксалата кальция [6, 8, 9]. Было обнаружено, что пиридоксин полезен у пациентов с первичной гипероксалурией 1 типа за счет снижения экскреции оксалатов с мочой [10]. Определенным радикальным лечением пациентов с первичной гипероксалурией 1 типа является комбинированная трансплантация печени и почки; однако роль трансплантации печени у пациентов с первичной гипероксалурией 2-го типа до сих пор неясна. Упреждающую комбинированную трансплантацию печени и почек следует рассматривать у пациентов с первичной гипероксалурией и СКФ менее 30 мл/мин на 1,73 м2 [11].
Напротив, вторичная гипероксалурия может возникать из-за:
- повышенной абсорбции оксалатов
- дефицита питательных веществ
- недостаточный объем потребляемой жидкости
- снижения экскреции оксалатов
- повышенного потребления оксалатов с пищей.
Первым механизмом, приводящим ко вторичной гипероксалурии, является кишечная гипероксалурия. Кальций из пищи обычно связывается с оксалатом в кишечнике. В условиях мальабсорбции жира, кальций секвестрируется просветным жиром, что приводит к увеличению свободного оксалата в кишечнике и, таким образом, к увеличению реабсорбции [12]. В группе риска пациенты:
- после операции по уменьшению объема желудка
- с недостаточностью поджелудочной железы, болезнью Крона, глютеновой энтеропатией, муковисцидозом
- применяющие орлистат и октреотид и Clostridioides difficile колитом [13, 14, 15, 16, 17, 18, 19, 20].
Вторым механизмом, приводящим к вторичной гипероксалурии, является дефицит питательных веществ. Тиамин и пиридоксин — важные кофакторы глиоксилатного пути, их дефицит приводит к повышенному образованию оксалатов [21].
Третий механизм возникает при значительном снижении потребления жидкости. Снижение диуреза способствует образованию оксалатных камней из-за повышения концентрации оксалатов в моче.
Четвертый механизм — снижение экскреции оксалатов. При хроническом заболевании почек более низкая СКФ связана с повышенным уровнем оксалатов в плазме [22]. Степень нарушения функции почек часто коррелирует с концентрацией оксалатов в сыворотке [23]. Это связано с тем, что оксалат почти полностью удаляется из организма путем клубочковой фильтрации и секреции на уровне проксимальных канальцев [24- 29]. Когда уровень оксалата в плазме превышает 30 мкмоль/л, это приводит к его отложению в тканях, включая: сетчатку, миокард, стенки кровеносных сосудов, кости, кожу и центральную нервную систему [4].
Пятый механизм — повышенное содержание оксалатов в пище может привести ко вторичной гипероксалурии, особенно у пациентов с ХБП. Таблица 3 включает в себя список общих продуктов с высоким содержанием оксалата.
Таблица 3. Содержание оксалатов (мг/100 г) в некоторых распространенных продуктах питания [3]
| Продукты | мг/100 г |
| Чай | 1150 |
| Шпинат | 970 |
| Ревень сырой | 805 |
| Какао | 700 |
| Листья свеклы | 610 |
| Ревень тушеный | 460 |
| Красная свекла | 275 |
| Петрушка | 170 |
| Кофе | 100 |
| Картофель | 80 |
| Капуста | 60 |
| Черная смородина | 50 |
| Помидор | 20 |
| Яблоко | 15 |
| Латук | 12 |
Кроме того, витамин С и этиленгликоль являются важными источниками предшественников оксалатов. Недавние исследования показывают, что около 50% оксалатов в моче поступает из пищи [30, 31]. Диетический оксалат абсорбируется в кишечнике транспортерами семейства SLC26 как через парацеллюлярный, так и через трансцеллюлярный пути [32]. На кишечную абсорбцию оксалата влияет биодоступность потребленного оксалата [33].
Лечение вторичной гипероксалурии включает:
- соблюдение диеты с низким содержанием оксалатов и высоким содержанием кальция
- увеличение потребления жидкости (>3 л/1,73 м2 ),
- добавление кальция или других веществ, связывающих оксалаты и секвестранты желчных кислот снижает всасывание оксалатов в кишечнике
- потребление пробиотиков, содержащих бактерии, разлагающие оксалаты, однако недавние исследования не доказали их определенной эффективности [11, 34].
Спектр заболеваний гипероксалурии варьирует от нефрокальциноза, нефролитиаза до оксалатной нефропатии. Нефрокальциноз и нефролитиаз могут оставаться бессимптомными, с медленным прогрессированием ХБП, часто обнаруживаемым случайно при рентгенологическом исследовании. Острая оксалатная нефропатия характеризуется ОПП и часто прогрессирует до ТХБП. В таком случае может потребоваться заместительная почечная терапия, а при подозрении на первичную гипероксалурию может потребоваться комбинированная трансплантация печени и почек [4, 35, 36].
Вывод
Пациенты с предрасполагающими заболеваниями, такими как ХБП, имеют более высокий риск развития оксалат-индуцированной нефропатии. Кроме того, случай иллюстрирует важность биопсии почки для определения этиологии ОПП, когда этиология остается неясной. Особое внимание следует уделять вторичным причинам гипероксалурии, в частности, диетическим привычкам у пациентов с предрасполагающими к ней состояниями, такими как ХБП.
Ссылка на оригинальную статью.
Литература:
- Williams HE. Oxalic acid and the hyperoxaluric syndromes. Kidney Int. 1978;13(5):410—7.
- Thompson CS, Weinman EJ. The significance of oxalate in renal failure. Am J Kidney Dis. 1984;4:97—100.
- Noonan SC, Savage GP. Oxalate content of foods and its effect on humans. Asia Pac J Clin Nutr. 1999;8:64—74.
- Karaolanis G, Lionaki S, Moris D, et al. Secondary hyperoxaluria: a risk factor for kidney stone formation and renal failure in native kidneys and renal grafts. Transplant Rev (Orlando). 2014;28:182—7.
- Cochat P, Rumsby G. Primary hyperoxaluria. N Engl J Med. 2013;369:649—58.
- Hoppe B. An update on primary hyperoxaluria. Nat Rev Nephrol. 2012;8:467—75.
- Lieske JC, Monico CG, Holmes WS, et al. International registry for primary hyperoxaluria. Am J Nephrol. 2005;25:290—6.
- Cochat P, Hulton SA, Acquaviva C, et al. Primary hyperoxaluria Type 1: indications for screening and guidance for diagnosis and treatment. Nephrol Dial Transplant. 2012;27:1729—36.
- Leumann E, Hoppe B, Neuhaus T. Management of primary hyperoxaluria: efficacy of oral citrate administration. Pediatr Nephrol. 1993;7:207—11.
- Milliner DS, Eickholt JT, Bergstralh EJ, et al. Results of long-term treatment with orthophosphate and pyridoxine in patients with primary hyperoxaluria. N Engl J Med. 1994;331:1553—8.
- Hoppe B, Beck BB, Milliner DS. The primary hyperoxalurias. Kidney Int. 2009;75:1264—71.
- Robijn S, Hoppe B, Vervaet BA, et al. Hyperoxaluria: a gut-kidney axis? Kidney Int. 2011;80:1146—58.
- Whitson JM, Stackhouse GB, Stoller ML. Hyperoxaluria after modern bariatric surgery: case series and literature review. Int Urol Nephrol. 2010;42:369—74.
- Cartery C, Faguer S, Karras A, et al. Oxalate nephropathy associated with chronic pancreatitis. Clin J Am Soc Nephrol. 2011;6:1895—902.
- Siener R, Petzold J, Bitterlich N, et al. Determinants of urolithiasis in patients with intestinal fat malabsorption. Urology. 2013;81:17—24.
- Gibney EM, Goldfarb DS. The association of nephrolithiasis with cystic fibrosis. Am J Kidney Dis. 2003;42:1—11.
- Allen A, Clutterbuck E, Maidment G, et al. Enteric hyperoxaluria and renal failure associated with lymphangiectasia. Nephrol Dial Transplant. 1997;12:802—6.
- Dossabhoy NR, McRight S, Sangha B, et al. Orlistat-induced oxalate nephropathy may be dose-independent and present as a late manifestation. J La State Med Soc. 2013;165:283—5.
- Gariani K, de Seigneux S, Courbebaisse M, et al. Oxalate nephropathy induced by octreotide treatment for acromegaly: a case report. J Med Case Rep. 2012;6:215.
- Cohen-Bucay A, Garimella P, Ezeokonkwo C, et al. Acute oxalate nephropathy associated with Clostridium difficile colitis. Am J Kidney Dis. 2014;63:113—8.
- Siener R, Ebert D, Nicolay C, et al. Dietary risk factors for hyperoxaluria in calcium oxalate stone formers. Kidney Int. 2003;63:1037—43.
- Constable AR, Joekes AM, Kasidas GP, et al. Plasma level and renal clearance of oxalate in normal subjects and in patients with primary hyperoxaluria or chronic renal failure or both. Clin Sci (Lond). 1979;56:299—304.
- Camici M, Balestri PL, Lupetti S, et al. Urinary excretion of oxalate in renal failure. Nephron. 1982;30:269—70.
- Elder TD, Wyngaarden JB. The biosynthesis and turnover of oxalate in normal and hyperoxaluric subjects. J Clin Invest. 1960;39:1337—44.
- Hodgkinson A, Wilkinson R. Plasma oxalate concentration and renal excretion of oxalate in man. Clin Sci Mol Med. 1974;46:61—73.
- Prenen JAC, Boer P, Dorhout Mees EJ, et al. Determination of oxalic acid clearance and plasma concentration by radioisotope infusion. Results in a family with hyperoxaluria. Acta Med Scand. 1981;209:87—91.
- Weinman EJ, Frankfurt SJ, Ince A, et al. Renal tubular transport of organic acids. Studies with oxalate and para-aminohippurate in the rat. J Clin Invest. 1978;61:801—6.
- Knight TF, Sansom SC, Senekjian HO, et al. Oxalate secretion in the rat proximal tubule. Am J Physiol. 1981;240:F295—8.
- Senekjian HO, Weinman EJ. Oxalate transport by proximal tubule of the rabbit kidney. Am J Physiol. 1982;243:F271—5.
- Holmes RP, Goodman HO, Assimos DG. Contribution of dietary oxalate to urinary oxalate excretion. Kidney Int. 2001;59:270—6.
- Khan SR, Glenton PA, Byer KJ. Dietary oxalate and calcium oxalate nephrolithiasis. J Urol. 2007;178:2191—6.
- Freel RW, Whittamore JM, Hatch M. Transcellular oxalate and Cl- absorption in mouse intestine is mediated by the DRA anion exchanger Slc26a3, and DRA deletion decreases urinary oxalate. Am J Physiol Gastrointest Liver Physiol. 2013;305:G520—7.
- Mitchell T, Kumar P, Reddy T, et al. Dietary oxalate and kidney stone formation. Am J Physiol Renal Physiol. 2019;316:F409—13.
- Kumar R, Lieske JC, Collazo-Clavell ML, et al. Fat malabsorption and increased intestinal oxalate absorption are common after Roux-en-Y gastric bypass surgery. Surgery. 2011;149:654—61.
- Stepien KM, Prinsloo P, Hitch T, et al. Acute renal failure, microangiopathic haemolytic anemia, and secondary oxalosis in a young female patient. Int J Nephrol. 2011;2011:679160.
- Detry O, Honoré P, DeRoover A, et al. Reversal of oxalosis cardiomyopathy after combined liver and kidney transplantation. Transplant Int. 2002;15:50—2.





