Группа препаратов макролиды: преимущества и недостатки
Макролиды: преимущества и недостатки
1949 год. Недавно закончилась вторая мировая война. Открытый в 1928 году пенициллин во время войны спас множество жизней и вдохновил ученых всего мира на поиск новых антибиотиков. На Филиппинах представителем американского фармацевтического завода Eli Lilly работает доктор Абелардо Агилар [1].

Источник: https://filipiknow.net/abelardo-aguilar-erythromycin/
В почве своей родной провинции Илоило Агилар обнаруживает бактерии-актиномицеты Saccharopolyspora erytheraea (или Strepromyces erythrae), которые проявляют антимикробную активность. Он отправляет образец своему работодателю [2]. Из этого образца в исследовательской лаборатории Eli Lilly выделяют макролидный антибиотик, который авторы патента [3], Роберт Банч и Джеймс Макгуайер (Robert L.Bunch и James M.Mcguire), назовут эритромицином — колонии Streptomyces erythrae [4]
имеют красноватый оттенок, «....» в переводе с греческого — красный[5].
Строение его молекулы настолько сложное, что нобелевский лауреат, химик Роберт Бернс Вудворд : «Синтез эритромицина, при всех его преимуществах, выглядит в настоящее время совершенно безнадежным», но это не помешает Eli Lilly производить его с использованием проверенного метода ферментации из природного сырья в течение многих десятилетий. И только в 1981 году молекулу эритромицина смогли синтезировать в лаборатории [7].
В тоже время антибиотики продолжают искать буквально везде: в растениях, в живых организмах, в образцах почвы. Благодаря таким интенсивным поискам, в 50-х годах прошлого века, уже после открытия эритромицина, ученые нашли множество новых макролидов, лишь малое число из которых применяются в практике: олеандомицин, мидекамицин и джозамицин в Японии, спирамицин в Европе и эритромицин и карбомицин в Соединенных Штатах.
Происхождение названия
В 1957 предлагает называть макролиды макролидами — термин [8] для описания больших (макро) молекул с антибактериальной активностью, которые состоят из 14-, 15- или 16-членных и более лактамных колец. От лактамных колец появилась «л» в названии группы. Лактамы являются циклическими амидами, отсюда появился суффикс «ид». Число членов определяется количеством атомов углерода в составе кольца, к которым присоединены остатки разных сахаров.
Эритромицин, например, имеет 14-членное кольцо, а джозамицин - 16-членное.
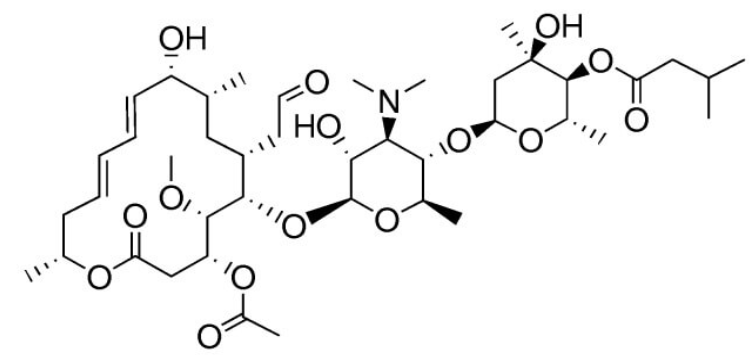
Источник: https://www.scbt.com/fr/p/josamycin-16846-24-5
Эритромицин и первое поколение
Первый макролид, эритромицин, под коммерческими названиями «Илозон» и «Илотицин» в честь филиппинской провинции Илоило [9], в почве которой он и был впервые обнаружен) начинают применять в клинической практике в 1958 году для лечения инфекций, в основном, вызванных грамположительными бактериями, в том числе, золотистым стафилококком (S. aureus ) [10]. Эритромицин становится альтернативой для пациентов с аллергией на пенициллин.
«Если применение бензилпенициллина противопоказано по тем или иным причинам, то в качестве первого альтернативного антибиотика следует выбрать эритромицин при диагностированной грамположительной кокковой инфекции» — говорится в
учебнике 1964 года по лечебному делу клиники терапии и клинической медицины Эдинбургского университета (9-е изд., 1964, стр. 68). Для любителей раритетных книг, pdf книги доступен .
Первое поколение макролидов: мидекамицин, джозамицин, спирамицин, эритромицин, карбомицин, олеандомицин.
Недостатки макролидов
Хотя первые макролиды и проявляли превосходную антибактериальную активность в отношении чувствительных к ним возбудителей, их отличала [11-13]:
- плохая биодоступность — для эритромицина при пероральном приеме 25%
- непредсказуемая фармакокинетика — эритромицин на 70–80% связывается белками плазмы
- быстрое выведение, из-за чего макролиды приходилось назначать три-четыре раза в день (период полувыведения эритромицина, например, составляет от 1,5 до 2 часов
- низкая стабильность в кислой среде. В желудке эритромицин распадается до неактивного в качестве антибиотика соединения, которое может вызвать побочные эффекты со стороны желудочно-кишечного тракта.
Решением этих проблем стало создание полусинтетических молекул с лучшими фармакокинетическими показателями и внедрение новых форм выпуска, позволяющих защитить нестабильные в кислой среде желудка макролиды от преждевременного распада, например, таблетки с кишечнорастворимой оболочкой.
Преимущества макролидов
Несомненное достоинство макролидов — способность проникать внутрь клеток и создавать длительно сохраняющиеся высокие внутриклеточные концентрации: концентрация эритромицина в тканях в 17 раз выше, чем в сыворотке крови. Макролиды обнаруживаются в перитонеальной жидкости и грудном молоке, но не проникают в спинномозговую жидкость, где их концентрация составляет всего 2–13% от концентрации в плазме [14].
Особенно высока тропность макролидов к фосфолипидному слою мембран клеток, участвующих в фагоцитозе — нейтрофилов, моноцитов, альвеолярных макрофагов [15]. Макролиды накапливаются в фагоцитах, которые транспортируют их к месту инфекции[16]. Концентрации кларитромицина и азитромицина в фагоцитах в 400 и 800 раз превышают их концентрацию в сыворотке крови [13].
Эволюция группы и второе поколение макролидов
Ограничения в спектре антибактериального действия и проблемы с фармакокинетикой первых макролидов привели к поиску новых молекул и синтезу новых на основе уже найденных.
В результате, спустя долгие 20 лет, в 80-е, появилось второе поколение — полусинтетические производные эритромицина с лучшими фармакокинетическими свойствами [17]. Поиск новых антибиотиков этой группы добавил к списку потенциальных кандидатов 505 различных молекул за период с 1990 по 2020 годы [18]. На основе эритромицина было синтезировано 5 полусинтетических производных: кларитромицин [19], диритромицин [20], рокситромицин [21], флуритромицин [22] и азитромицин [23]. Из них самые известные — кларитромицин и азитромицин широко применяются в клинической практике во всем мире до сих пор, в то время как остальные известны гораздо меньше.
По сравнению с эритромицином, кларитромицин и азитромицин:
- выводятся из организма гораздо медленнее: период полувыведения азитромицина 35-54 часа, кларитромицина — 5 часов [24]
- имеют большую биодоступность: азитромицин — 37-38 % [15], кларитромицин — 50% [25]
- применяются только один или 2 раза в день [26, 27]
- обладают большей стабильностью в кислой среде: кислотоустойчивость азитромицина [28] и кларитромицина в несколько раз больше, чем у эритромицина [29]
- лучше проникают в ткани благодаря более высокой липофильности и, следовательно, более эффективны для лечения внутриклеточных патогенов, таких как H. influenzae [30]
- способны создавать высокую концентрацию в легочной ткани [31] , почти в 50 раз более высокую, чем в плазме, и распределяются преимущественно в селезенке, печени, легких и почках.
Хотя поиск макролидов второго поколения был предпринят с расчётом обнаружить соединения с расширенным спектром антибактериального действия, их эффективность в отношении грамположительных бактерий не выше, а у азитромицина даже ниже, чем у родоначальника группы — эритромицина [32].
Что касается грамотрицательных бактерий, то и кларитромицин и азитромицин более эффективны, чем первое поколение в борьбе против микоплазмы (Mycoplasma pneumonia), хеликобактер пилори (Helicobacter pylori) и токсоплазмы (Toxoplasma gondii) [33], но активность азитромицина выше в их отношении, чем у кларитромицина. Считается, что более высокая стабильность и большая способность накапливаться в тканях, позволяет азитромицину легче проникать через трудно проницаемую клеточную стенку грамотрицательных бактерий [34] .
Резистентность и третье поколение макролидов
Не миновала макролиды и судьба остальных антибиотиков — бактерии начали успешно приспосабливаться к ним. В США в 1997 г. частота резистентности к представителям этой группы достигала 26%, во Франции – 45%, в Испании – 32,6%. В России примерно в это же время резистентность Streptococcus pneumoniae к кларитромицину составляла в среднем 5,5% [38]. А в 2017 году, по данным российского исследования ПеГАС V — уже до 31% [39].






