Как лекарства умеют бороться с вирусами на примере двух новых ЛС
Как лекарства умеют бороться с вирусами на примере двух новых ЛС
Вирусы вызывают многие опасные инфекции. Поэтому создание ЛС, способных бороться с вирусами, – актуальнейший фронт фармакологии. Поиск подобных препаратов — нелегкая задача, т.к. мишенью ЛС может быть селективная блокада «входных ворот» вируса в клетку или еще более сложная мишень – проникновение внутрь клетки хозяина или блокирование молекул (вируса или хозяина), необходимых для создания новых вирионов. Расскажем о двух свежих противовирусных ЛС, японском и российском.
Энситрелвир 1-8
Разработка японской компании Shionogi в партнерстве с Университетом Хоккайдо. Разработка препарата была обусловлена вспыхнувшей пандемией COVID-19. Shionogi планировала выпустить препарат на японский рынок еще в марте 2022 года, однако даже в условиях пандемии местный регулятор не пошел на уступки – не утвердил ЛС, имеющее незначительный объем клинических данных. Однако в ноябре 2022 года японский регулятор одобрил ЛС для экстренного применения в Японии. Сегодня Энситрелвир проходит лишь 3-ю фазу клинических испытаний и не доступен для широкой покупки даже в самой Японии.
Другие страны также рассматривают возможность использования препарата. Так в сентябре 2022 Shionogi договорилась с Ildong Pharmceutical о запуске ЛС в Южной Корее. В начале октября 2022 года было заключено соглашение с МРР (фонд патентного пула лекарственных средств), целью которого было дать возможность ряду стран (Азербайджан, Армения, Грузия, Кахазстан, Киргизия, Молдовия, Таджикистан, Узбекистан и др.) получить препарат. Россия в данный договор включена не была. В целом выход Энситрелвира на международный рынок возможен не раньше второй половины 2023 года.
Энситрелвир – это селективный ингибитор 3С-подобной протеазы. Ингибирование 3С-подобной протеазы нарушает расщепление полипротеина рр1ab, что в конечном итоге нарушает работу комплекса репликации-транскрипции (RTC). Без комлекса RTC синтез РНК невозможен, следовательно, кодируемые ими структурные и вспомогательные белки не образуются. Таким образом, Энситрелвир нарушает образование вирионов, блокируя матричные процессы внутри клетки мишени вируса. Наиболее частые нежелательные явления включают преходящее снижение уровня липопротеинов высокой плотности и повышение уровня триглицеридов в крови. Препарат выпускается в форме таблеток. В первый день необходимо принять per os 125 мг x 3р/сут, затем начиная со 2-го дня по 125 мг х 1р/сут. Основной конкурент для Эситрелвира– Паксловид (Нирматрелвир+Рионавир). Сравнение ЛС представлено в таблице №1.
Изучение эффективности. Фазы IIa была проведена на 47 пациентах. Данная фаза показала, что эситрелвир быстро снижает титр вирусной РНК, на 4-ый день пропорция пациентов с положительным титром вируса снизилась на 60-80%. Медиана времени до отрицательного вирусного титра составила около 2,5 суток (в группе плацебо – 4,5 суток). В группе эситрелвира госпитализации отсутствовали, а в группе плацебо госпитализированы 14,3% испытуемых, почти все побочные реакции носили легкую степень тяжести и к ним относились: назофаренгит, головная боль, риналгия, снижение уровня ЛПВП, рост концентрации ТАГ в крови, повышение АСТ, АЛТ билирубина. Фаза IIb была проведена на 428 пациентах. Быстрее снижался титр вирусной РНК в группе пациентов получающих ЛС. На 4-ый день в данной группе положительный титр был лишь у 10% испытуемых, скорость снижения титра была в 2,5 раза быстрее в сравнении с группой плацебо. Фаза III показала показала аналогичные результаты. Серьезных побочных эффектов зафиксировано не было.
Табл. 1. Преимущества Эситрелвира над Паксловидом.
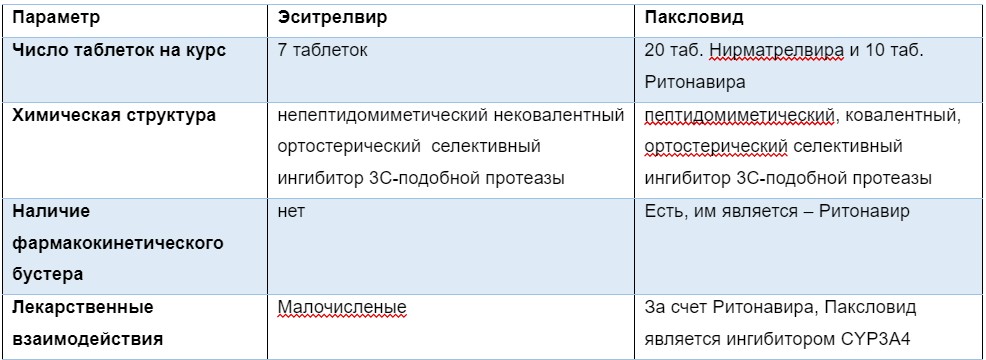
* Пептидомиметик — это вещества небелковой природы, имеющие такие же функциональные фрагменты, как и конкретный пептид, а потому обладающие такой же активностью.
* Ковалентный/нековаленый – говорится о возможности формировать ковалентыне связи, как правило это крайне крепкие химические связя, которые после формирования в обычных услвоиях сложно разорвать. Следовательно данные связи обуславливают необратимость связывания ЛС со своей мишенью.
* Ортостерический – лиганд связывающийся с сновным сайтом связывания мишени.
МИР-19 9-13
Новый российский препарат для лечения короновируса, взявший на вооружение технологию РНК-интерференции (процесс подавления экспрессии гена на стадии транскрипции, трансляции, деаденилирования или деградации мРНК при помощи малых молекул РНК). Препарат был разработан ФГБУ «Государственный Научный Центр "Институт иммунологии" ФМБА России». Клинические испытания препарата I фазы завершились в 2021 году. В сентябре 2021 закончился набор во II фазу клинических исследований. 19 октября оперативный штаб по борьбе с COVID-19 в РФ сообщил о завершении II фазы исследований и подаче документов на регистрацию препарата. 22 января 2021 года препарат зарегистрирован в системе ГРЛС по регистрационным номером ЛП-007720. После 21 января 2022 года подана заявка на начало пострегистрационных исследований ЛС на 1000 добровольцах в амбулаторных условиях на ранних стадиях заболевания. 15.08.2022 глава ФМБА (Вероника Игоревна Скворцова) заявила о завершении клинических испытаний препарата. Выход препарата на рынок был запланирован на август 2022 года; на начало 2023 года препарат не доступен в свободной продаже. О планах выпустить МИР-19 на зарубежные рынки на сегодняшний момент неизвестно.
Состав МИР-19:
- Синтетическая малая интерферирующая РНК (миРНК) – основное действующее вещество, входящее во флакон из прозрачного стекла №1 в количестве 0,088 мг.
- Растворитель для лиофилизата – фосфатно-солевой буферный раствор в прозрачных флаконах № 2 и №4 по 2,5 мг каждый.
- Пептид КК-46 – белый или желтоватый аморфный вспомогательный порошок, входящий в флакон №3 в количестве 1,762 мг.
Лиофилизат для приготовления раствора для ингаляций. Вводят препарат при помощи в дозе 1,85 мг х2р/сут в течении 14 дней.
Срок годности составляет 1 год при температуре не выше 2-8 С, препарат рекомендуется не замораживать. Препарат не входит в перечень ЖНЛВП, отпускается без рецепта.
Молекулы миРНК после проникновения в клетку нарушают работу гена, кодирующего РНК-зависимую РНК-полимеразу, что приводит к нарушению матричных процессов и, следовательно, подавлению репликации вируса. Пептид КК-46 способствует поглощению основного действующего вещества клетками. В качестве вектора используется плазмида pVAX-1.
Вводится препарат ингаляционно, не проникает через ГЭБ. Метаболизм осуществляется немикросомальным гидролизом, т.е. без участия системы цитохромов Р450. Период полувыведения – очень небольшой, всего 23 минуты, выводится почками и кишечником. В рамках проведенных клинических исследований причинно-следственная связь развившихся нежелательных реакций с применением миРНК не установлена. Показание к применению — лечение новой коронавирусной инфекции (COVID-19) у взрослых в возрасте от 18 до 65 лет. МИР-19 включен в актуальные рекомендации для лечения COVID-19. Препарат противопоказан пациентам с тяжелым течением COVID-19, при беременность и в период грудного вскармливания, а также пациентам, использующим на постоянной основе системные ГКС.
Изучение эффективности. МИР-19 в 50 раз снижал вирусную нагрузку в опытах на животных на 2 сутки. Клинические исследования доказали безопасность и эффективность препарата и установили, что он снижает вирусную нагрузку в 10 тысяч раз. В течение первой фазы испытаний у здоровых добровольцев наблюдалась хорошая переносимость препарата.
Источники:
1. "Xocova (Ensitrelvir Fumaric Acid) Tablets 125mg Approved in Japan for the Treatment of SARS-CoV-2 Infection, under the Emergency Regulatory Approval System". Shionogi (Press release). 22 November 2022.
2. "Shionogi's new COVID pill appears to ease omicron symptoms". Nikkei Asia. 21 December 2021.
3. Uraki R, Kiso M, Iida S, Imai M, Takashita E, Kuroda M, et al. (IASO study team) (May 2022). "Characterization and antiviral susceptibility of SARS-CoV-2 Omicron/BA.2". Nature. 607 (7917): 119-127. doi:10.1038/s41586-022-04856-1. PMID 35576972. S2CID 248833104
4. McCarthy MW (December 2022). "Ensitrelvir as a potential treatment for COVID-19". Expert Opin Pharmacother. 23 (18): 1995–1998. doi:10.1080/14656566.2022.2146493. PMID 36350029. S2CID 253418404..
5. Fujikawa M (22 November 2022). "Japan Approves First Homegrown Covid-19 Antiviral Pill". The Wall Street Journal.
6. "Shionogi's Covid antiviral lands first approval in Japan's new emergency approval pathway". Endpoints News. 22 November 2022.
7. "Xocova: Powerful New Japanese Pill for Coronavirus Treatment". BioPharma Media. February 2022.
8. Tyndall JD (May 2022). "S-217622, a 3CL Protease Inhibitor and Clinical Candidate for SARS-CoV-2". Journal of Medicinal Chemistry. 65 (9): 6496–6498. doi: 10.1021/acs.jmedchem.2c00624.
PMID 35507419. S2CID 248513467.
9. «МИР 19». Директор Института иммунологии ФМБА Муса Хаитов — о новом лекарстве от COVID-19 и тестировании вакцины от аллергии на березу от 23 января 2022 на Wayback Machine // 20.04.2021 г. «Известия».
10. Российское лекарство от ковида на базе РНК-интерференции показало эффективность на хомяках. nplus1.ru. 14 ноября 2021 года.
11. Musa Khaitov, Alexandra Nikonova, Igor Shilovskiy, Ksenia Kozhikhova, Ilya Kofiadi. Silencing of SARS-CoV-2 with modified siRNA-peptide dendrimer formulation // Allergy. — 2021. — Vol. 76, iss. 9. — P. 2840–2854. — ISSN 1398-9995. — doi: 10.1111/all.14850
12. Государственный реестр лекарственных средств (rosminzdrav.ru): https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=bb62a3b8-7b38-4d71-aa9b-51660813a32a
13. Musa Khaitov, Alexandra Nikonova, Igor Shilovskiy, Ksenia Kozhikhova, Ilya Kofiadi. Silencing of SARS-CoV-2 with modified siRNA-peptide dendrimer formulation (англ.) // Allergy. — 2021. — Vol. 76, iss. 9. — P. 2840–2854.





