Моноклональные антитела: обзор препаратов
Обзор терапевтических моноклональных антител — специфическая терапия. Лекарства ХХI века.
Понимание патогенеза онкологических и аутоиммунных заболеваний одной стороны и достижения в биотехнологии и генной инженерии с другой стороны привели к появлению препаратов на основе моноклональных антител (МАТ). Применение моноклональных антител стало принципиально новым подходом в терапии. В отличие от традиционных препаратов, МАТ высокоспецифичны к определенным мишеням, поэтому терапия данным классом препаратов получила название прицельной или таргетной.
Схема получения МАТ
Моноклональное антитело — это иммуноглобулин, специфичный к конкретному антигену (АГ), вырабатываемый В-лимфоцитами — клонами одной родительской клетки. Каждая клетка клона идентична клетке-предшественнице, а продуцируемые ими МАТ имеют одинаковую структуру и свойства.
Биотехнологическое создание МАТ стало возможным благодаря гибридомной технологии, разработанной в 1975 году французами Жоржем Кёлером и Сезаром Мильштейном. В упрощенном виде процесс выглядел так:
- В организм мыши вводился АГ, который вызывал выработку соответствующего антитела (АТ).
- После получения иммунного ответа клетки селезенки смешивали с клетками миеломы для получения гибридомы — клеточной линии, наследующей от В-лимфоцитов селезенки способность продуцировать нужное антитело, а от клеток миеломы способность к выживанию в искусственных условиях и к неограниченному росту.
- Клон гибридом отделяли в селективной среде от неслившихся миеломных клеток и В-лимфоцитов и культивировали для получения больших объемов МАТ.
Рис.1 Основные этапы получения гибридомы (источник)
Типы и номенклатура МАТ
Первым препаратом МАТ, вышедшим на рынок в 1986 году, стал препарат для предотвращения отторжения трансплантированной почки — Orthoclone ОКТ-З/Мурономаб CD-3. Его полностью мышиное происхождение приводило к образованию человеческих антимышиных АТ и быстрой нейтрализации терапевтического эффекта. Снизить иммуногенность МАТ получилось в начале 90-х, когда с помощью методов генной инженерии были созданы химерные МАТ: константные участки мышиного иммуноглобулина были заменены участками человеческого иммуноглобулина. За ними последовали гуманизированные МАТ — еще менее иммуногенные. 90-95% молекулы гуманизированного МАТ составляет человеческий иммуноглобулин. Мышиными в них остаются только гипервариабельные участки, ответственные за связывание с антигеном. И, наконец, последние МАТ, обладающие самой низкой иммуногенностью — полностью человеческие. Их появление стало возможным благодаря новейшим биотехнологиям, в частности, метода «фагового дисплея».
Рис. 2 Схема строения мышиных, химерных, гуманизированных и человеческих антител
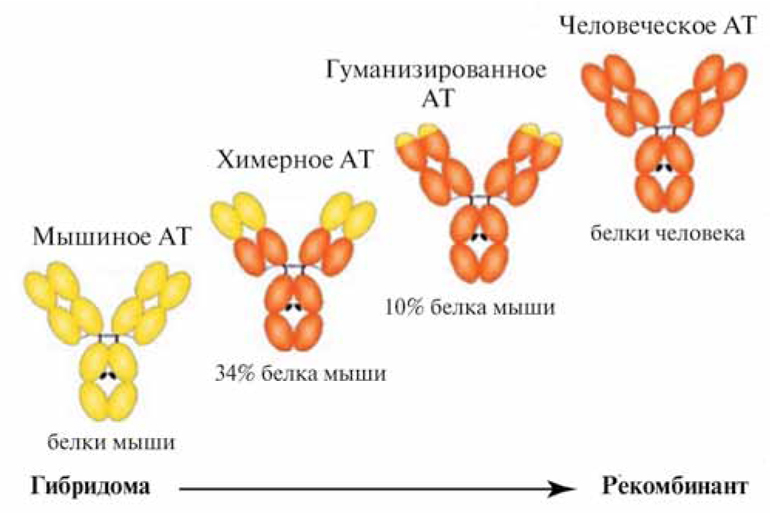
Международные непатентовнные наименования препаратов моноклональных антител обычно заканчиваются суффиксом «маб» (от англ. Monoclonal AntiBody). По наименованию также можно определить тип МАТ.
| Иммуногенность | Тип | Доля последовательности, % | INN окончание | ||
| Мышь | Человек | ||||
| с н и ж а е т с я |
↓ | Мышиные | 100 | 0 | момаб |
| Химерные | 33 | 67 | ксимаб | ||
| Гуманизированные | 5-10 | 90-95 | зумаб | ||
| Человеческие | 0 | 100 | умаб | ||
Пример: Пертузумаб — гуманизированное МАТ для лечения рака молочной железы, ассоциированного с гиперэкспрессией гена HER2.
Возможны также сочетания:
и+маб — примат
ксизу+маб — комбинация химерных и гуманизированных последовательностей
а+маб — крыса
аксо+маб — крыса/мышь
е+маб — хомяк
Что лечат моноклональными антителами?
Подавляющее большинство всех производимых МАТ направлено на лечение онкологических и аутоиммунных заболеваний. Создано большое количество МАТ для терапии различных видов рака: рака молочной железы, колоректального, почечно-клеточного рака, лейкозов, миеломы, лимфомы, рака легкого и др. МАТ применяют при тяжелых формах иммунно-воспалительных и аутоиммунных заболеваний, таких как ревматоидный артрит, системная красная волчанка, псориаз, болезнь Крона, рассеянный склероз, бронхиальная астма. В круг заболеваний, для которых одобрены МАТ входят такие редко встречающиеся заболевания как пароксизмальная ночная гемоглобинурия, криопирин-ассоциированные периодические синдромы. Зарегистрированы МАТ для лечения тяжелой рецидивирующей мигрени, гиперхолистеринемиии, макулярной дегенерации зрения, остеопороза, профилактики инфекции, вызванной респираторно-синтициальным вирусом, у детей с высоким риском. Еще одна сфера применения МАТ — трансплантология. В настоящее время в России зарегистрировано более 40 наименований МАТ. Какие препараты зарегистрированы в России, для чего применяются и на какие мишени действуют смотрите в таблице.
Как действуют МАТ?
Каждое МАТ специализируется на определенной мишени, связанной с заболеванием. На сегодняшний день изучено немало таких мишеней.
Таблица 1. Некоторые, наиболее хорошо изученные клинические мишени.
| Клиническая мишень МАТ | С чем ассоциирована |
| фактор некроза опухоли альфа (ФНОα) | задействован в системных аутоиммунных заболеваниях |
| провоспалительные цитокины (интерлейкины) | участвуют в воспалительных аллергических и аутоиммунных реакциях |
| белок CD20 | присутствует на поверхности В-лимфоцитов, при В-клеточных лимфопролифативных заболеваниях |
| эпидермальный фактор роста (EGFR) | повышенная экспрессия может наблюдаться при раковых заболеваниях |
| рецептор 2 человеческого эпидермального фактора роста (HER2) | гиперэкспрессия встречается при раке молочной железы |
Механизмы действия МАТ на мишени очень многообразны. Так, МАТ, связываясь с факторами роста, цитокинами или их рецепторами блокируют их активность. МАТ к определенной популяции клеток способны связываться с ними и доставлять непосредственно к ним такие эффекторные элементы как токсины, ферменты, радиоактивные изотопы, цитокины и даже молекулы ДНК. Это свойство используется для разрушения раковых клеток.
Взаимодействие антиген-антитело может приводить к:
- блокировке действия определенной молекулы
- связыванию с определенными клетками
- модулированию сигнального пути.
Сигнальный эффект антител основан на сшивании рецепторов, связанных с медиаторами деления клетки или клеточной смерти либо на связи с рецепторами для активации определенной популяции клеток.
Проблемы применения МАТ
- Иммуногенность
Несмотря на то, что созданы гуманизированные и полностью человеческие моноклональные антитела, иммуногенность продолжает оставаться проблемой применения МАТ.
Таблица 2. Частота проявления иммуногенности препаратов МАТ у пациентов с различными заболеваниями
| Препарат | Тип МАТ | Мишень | Показания | Частота развития иммунного ответа |
| Мурономаб (ОКТЗ) | Мышиные | CD3 | Отторжения | 25% |
| Ритуксимаб (Мабтера) | Химерные | CD20 | Неходжскинская лимфома | 11% |
| Инфликсимаб (Ремикейд) | Химерные | TNFa | РА, болезнь Крона | 10-15% |
| Даклизумаб (Зенаракс) | Гуманизированные | IL-2R | Реакция отторжения | 14-34% |
| Трастузумаб (Герцептин) | Гуманизированные | Her2/neu | Рак молочной железы | <1% |
| Панитумумаб (Вектибикс) | Человеческие | EGFR | Колоректальный рак | 4,6% |
| Голимумаб (Симпони) | Человеческие | TNFa | РА, анкилозирующий спондилит | 4% |
Проявляться она может в виде инфузионных реакций, анафилаксии, снижении терапевтического действия лекарственного вещества.
- Побочные эффекты, связанные с иммунной системой
Поскольку МАТ вмешиваются в иммунологические реакции и изменяют работу какого-либо звена иммунитета, возникают связанные с этим побочные эффекты. Это может быть иммуносупрессия или наоборот чрезмерная активация иммунного ответа.
С применением МАТ связаны повышенные риски вирусных, инфекционных, онкологических заболеваний. Доказано, что терапия ингибиторами ФНО увеличивает риск развития лимфом, фармакогенной волчанки, туберкулеза и иных инфекционных процессов на фоне сниженного иммунитета1. Возможно ухудшение симптоматики при ишемической болезни сердца
МАТ, используемые в трансплантологии могут на 50% увеличить риск развития лимфопролиферативных заболеваний, в первую очередь В-лимфом, а также инфекционных осложнений1. У онкологических пациентов зафиксирована жизнеугрожающие состояния на фоне лечения блокатором роста эндотелия (VEGF) бевацизумабом (препарат Авастин): имеют место геморрагии, перфорация ЖКТ и другие осложнения. Препарат запретили в США для пациенток с раком молочной железы2. Описана возможность развития прогрессирующей мультифокальной лейкоэнцефалопатии (ПМЛ) при использовании натализумаба в терапии расеянного склероза. ПМЛ — прогрессирующее демиелинизирующее заболевание центральной нервной системы (ЦНС), вызванное реактивацией существующего в латентном состоянии вируса Джона Каннингема (JC-вирус), происходящая обычно при иммунодефицитных состояниях. Осложнение может приводить к инвалидизации и смертности3.
МАТ могут активировать избыточный иммунный ответ в виде каскада биологических реакций, результатом которого могут быть озноб, гриппоподобный синдром, миалгия. При неконтролируемом выбросе цитокинов может развиться цитокиновый шторм1. Чрезмерная постоянная стимуляция иммунного ответа при длительном применении МАТ может приводить к развитию аутоиммунных заболеваний1.
- Лекарственная форма
Все лекарственные формы МАТ инъекционные. Все МАТ вводятся под контролем врача, часто необходима премедикация антигистаминными или кортикостероидными препаратами. Пациент какое-то время должен находиться под наблюдением в условиях, позволяющих оказать неотложную медицинскую, в том числе реанимационную помощь в случае необходимости. Пероральные формы МАТ были бы очень удобны, но пока это дело будущих разработок. Пока же МАТ могут быть доставлены только при введении непосредственно в кровь, поскольку представляют собой крупные биологические молекулы и могут доставляться к месту воздействия только таким образом.
- Режим хранения и транспортирования
Поскольку все МАТ — это биотехнологические продукты, они требуют специальных условий хранения и перевозки: температурный режим от 2 до 8 градусов Цельсия. Все МАТ запрещено замораживать, а многие МАТ нельзя встряхивать и подвергать воздействию света.
- Стоимость
На сегодняшний день МАТ — это дорогостоящие препараты. Практически все они входят в список ЖНВЛП. Назначение и их реализация покрывается и контролируется государством. Лечение МАТ своими средствами недоступно для рядового пациента. Для того, чтобы пациент получил МАТ необходимы четкие показания и соответствующие обследования.
Итого
Производство МАТ — стремительно развивающийся сегмент фарминдустрии. МАТ только переживают свой апогей и имеют свой терапевтический потенциал. Исследуются новые мишени и разрабатываются новые МАТ. Моноклональные антитела позволили выйти на новый уровень в терапии широкого круга заболеваний. Однако внедрение МАТ не стало панацеей: МАТ не действуют на причину заболевания. Их действие направлено на подавление различных механизмов развития заболеваний, а следовательно они не излечивают болезнь до конца, однако способны значительно повлиять на ее течение и прогноз. Скорее стоит рассматривать МАТ как значимый дополнительный терапевтический ресурс в руках врача, а максимальную пользу пациенту принесет комплексный подход и назначение различных классов препаратов с учетом всех сопутствующих обстоятельств.
Источники
- Авдеева, Ж. И., Алпатова, Н. А., Солдатов, А. А., Бондарев, В. П., Мосягин, В. Д., & Медуницын, Н. В. (2015). Безопасность лекарственных препаратов моноклональных антител, связанная с проявлением их иммуногенности. Иммунология, 36(4), 247-256.
- Иванов, А. А., & Белецкий, И. П. (2011). Терапия моноклональными антителами-панацея или паллиатив?. Ремедиум. Журнал о российском рынке лекарств и медицинской технике, (3), 12-16.
- Захарова М.Н., Лысогорская Е.В., Иванова М.В., Кочергин И.А., & Коржова Ю.Е. (2018). Прогрессирующая мультифокальная лейкоэнцефалопатия как осложнение лечения препаратами, изменяющими течение рассеянного склероза. Анналы клинической и экспериментальной неврологии, 12 (4), 62-66.
Обсудить последние новости со всеми коллегами России вы можете в чатах:
- WhatsApp: https://chat.whatsapp.com/Izj3ZQ7aI36KK8e2dCjcm4
- Telegram: https://tglink.ru/joinchat/GWBPCkkLipQUnTbXrKqzGA
- ВКонтакте: https://vk.me/join/AJQ1dzabQRfHvl5Y2AOVUsgJ





