Синдром Гийена-Барре: симптомы, распространение, этиология и связь с вакцинацией
Синдром Гийена-Барре (часть 1). Симптомы, распространенность, этиология и клинические варианты
Синдром Гийена-Барре (СГБ) – острое, гетерогенное, иммуноопосредованное заболевание периферической нервной системы, характеризующееся быстро прогрессирующей симметричной слабостью конечностей с гипорефлексией или арефлексией; у некоторых пациентов возникают сенсорные нарушения и дефицит черепно-мозговых нервов. Он является самой частой причиной острого вялого паралича в постполиомиелитную эпоху. СГБ впервые был описан в 1916 году тремя французскими неврологами Жоржем Гийеном, Жаном-Александром Барре и Андре Стролом у двух солдат с повышенной концентрацией белка и нормальным количеством клеток в ликворе. В 1949 году Хеймейкер и его коллеги описали клинико-патологические особенности 50 смертельных случаев СГБ и отметили дегенерацию аксонов, разрушение миелина и отек нервов. В 1986 году Фисби и его коллеги дополнительно описали вариант СГБ с преимущественным прямым повреждением аксонов, а не демиелинизацией1. Этот вариант позже получил имя острой моторной аксональной нейропатией (AMAN), если были задействованы только моторные аксоны, и острой моторной сенсорной аксональной нейропатией (AMSAN), если поражались и чувствительные аксоны тоже. Среди других клинических форм выделяют острую воспалительную демиелинизирующую полирадикулонейропатию (AIDP) и синдром Миллера Фишера (MFS) с классической триадой арефлексии, атаксии и офтальмоплегии. Существуют менее распространенные варианты СГБ, такие как фаринго-цервико-брахиальная форма, включающая бибрахиальную форму и острую изолированную фарингеальную слабость, лицевую диплегию с парестезией, острую пандизавтономию, сенсорную форму, стволовой энцефалит Бикерстаффа и "перекрёстный" синдром2.
СГБ относится к демиелинизирующим полинейропатиям и характеризуется:
- симметричной слабостью конечностей
- гипорефлексией или быстро прогрессирующей арефлексией3.
Распространенность и этиология
Заболевание считается самой частой причиной периферических тетрапарезов. Распространенность колеблется от 1 до 2 случаев на 100 тысяч населения в год. Преимущественно заболеванию подвержены мужчины4,5. С возрастом риск развития заболевания возрастает.
В литературе встречается мнение, что синдром Гийена-Барре (СГБ) имеет генетическую предрасположенность, а острые бактериальные или вирусные инфекции, гельминтозы, вакцинация или хирургическая операция – лишь триггеры для развития патологического аутоиммунного процесса, приводящего к демиелинизации аксонов с последующим аксональным повреждением периферических нервных волокон5,6. Как правило, заболевшие анамнестически указывают на тот или иной провоцирующий фактор примерно за 4 недели до развития первых симптомов: от одной недели при вирусе Зика, до четырех-шести при поствакцинальном или хирургическом воздействи. Наиболее часто заболевание провоцируют инфекции:
- Campylobacter jejuni (35% случаев)
- цитомегаловирус (15%)
- вирус Эпштейна-Барр (10%)
- Micoplasma pneumoniae (5%)
- грипп, вирус ветряной оспы (Varicella zοster), Коксаки, гепатит Е7 и другие арбовирусы, гемофильная палочка и гельминтозы
Эти инфекции могут выступать пусковыми факторами аутоагрессии иммунной системы. В литературе описаны случаи поствакцинального развития СГБ, возникшего после иммунизации против гриппа, бешенства, дифтерии, коклюша и столбняка, полиомиелита и гепатита А. При поствакцинальном СГБ, скорее всего, имеет место направленная иммунная реактивность к периферическому миелину. Более редкими причинами развития СГБ могут быть хирургические вмешательства, при которых механическое повреждение периферического нерва вызывает высвобождение антигенов нейронов и реакции на них иммунной системы. Также лимфопролиферативные заболевания, в частности лимфома способствует пролиферации аутореактивных Т-клеток8. Аутоиммунная реакция приводит к повреждению нерва, его демиелинизации или функциональной блокаде нервной проводимости9.
Течение зависит от триггера
Типичный вариант развития заболевания схематично представлен на рисунке 1. Как говорилось выше, большинство пациентов с СГБ сообщают о предшествующей инфекции или другом провоцирующем агенте за 2-4 недели до появления первых симптомов. Часто у пациентов в дебюте заболевания можно обнаружить антиганглиозидные антитела, уровень которых со временем снижается. Симптоматика нарастает и достигает максимума в течение 2-4 недель. Восстановительный период может длиться от нескольких недель до месяцев, а в отдельных случаях и лет10.
Рисунок 1. Классическое течение синдрома Гийена-Барре
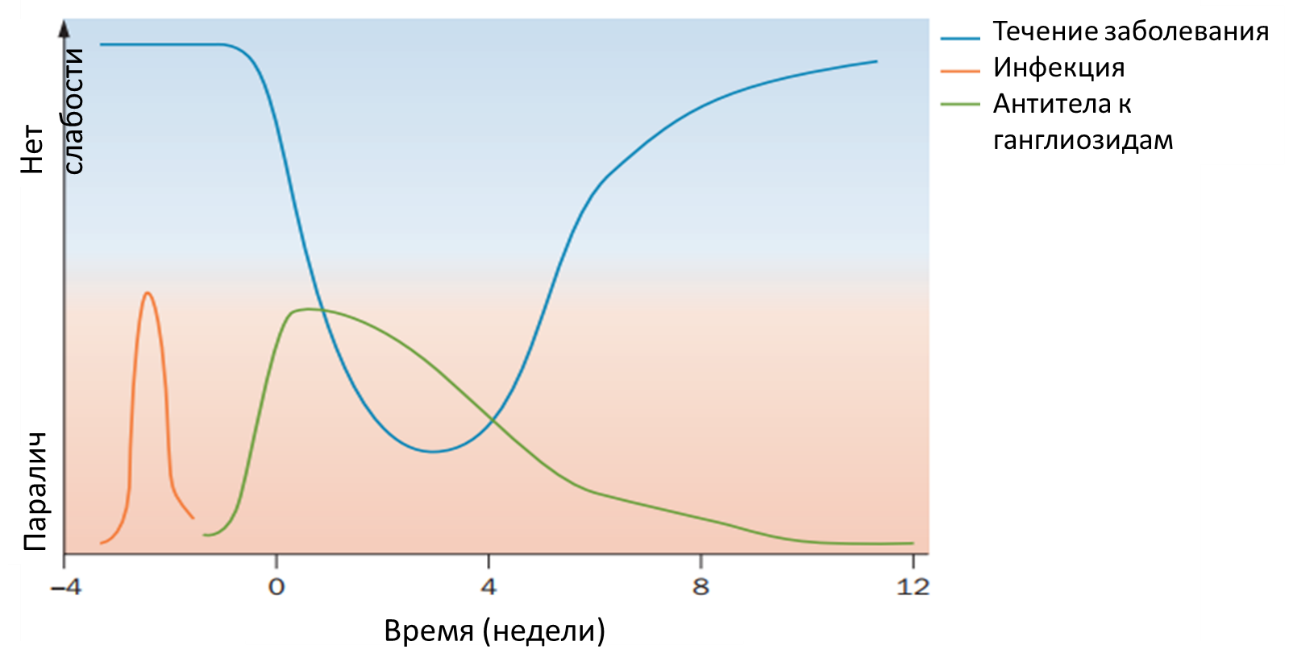
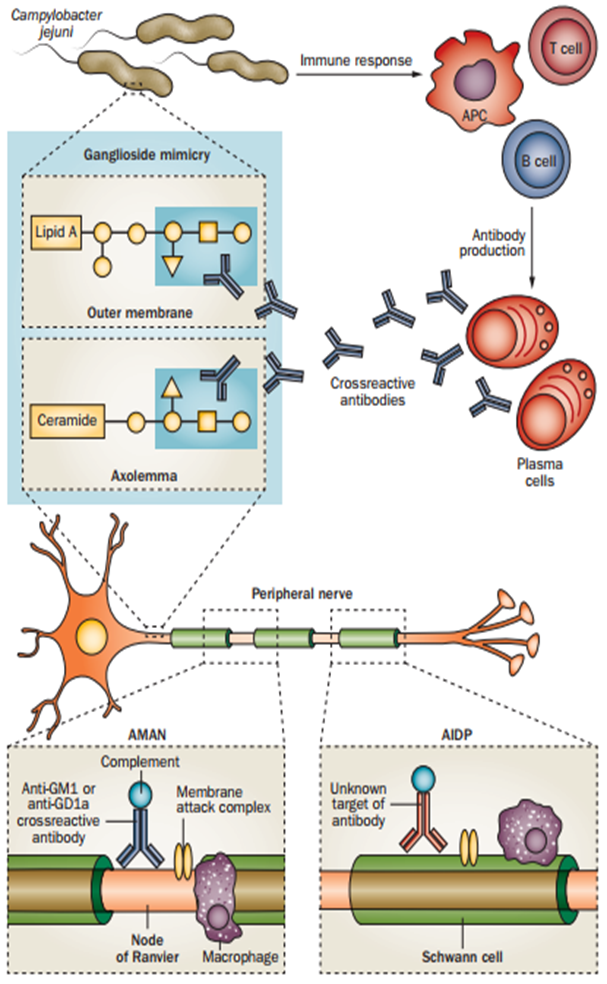
Триггер запускает патологический иммунный ответ, в ходе которого образуются аутоантитела, перекрестно реагирующие с ганглиозидами нейронов. Это становится возможным в следствие молекулярной мимикрии – схожей антигенной структуры между мукополисахаридами возбудителя и ганглиозидами периферического нерва. Штамм C. jejuni содержит на своей поверхности полисахариды, подобные углеводной части ганглиозидам периферических нервов. Липоолигосахариды C. jejuni вызывают выработку антител, которые перекрестно реагируют с ганглиозидами периферических нервов3. Антитела, перекрестно реагирующие с различными ганглиозидами, были не однократно описаны у пациентов с СГБ3,11-13. Однако только подгруппа штаммов C. jejuni содержит липоолигосахариды, которые имитируют углеводную часть ганглиозидов периферических нервов. Синтез этих углеводных структур, имитирующих ганглиозиды, зависит от набора полиморфных генов и ферментов, которые сильно различаются между различными штаммами C. Jejuni14. Вариант Thr51 гена C. jejuni cst II, например, связан с возникновением СГБ, в то время как Asn51 вариант связан с развитием другого демиелинизирующего синдрома — Миллера-Фишера (офтальмоплегия, атаксия и арефлексия). Это объясняется выработкой различных антител, которые мимикрируют к различным участкам ганглиозидов. Так, установлены специфические антитела, связанные с определенными подтипами СГБ и специфическими неврологическими нарушениями. Например, инфекции, вызванные C. Jejuni, как правило, связаны с AMAN или моторным подтипом СГБ и обнаруживают антитела Gm1, GM1b, GD1a или GalNAc-GD1a. А пациенты с синдромом Миллера-Фишера часто имеют антитела против ганглиозидов GD1b, GD3, GT1a и GQ1b, которые связаны с развитием атаксии и офтальмоплегии3.
Вирусы и СГБ
Проспективные исследования "случай-контроль" остаются золотым стандартом в установлении эпидемиологической связи СГБ с патогенами15. В подобных исследованиях была установлена причинно-следственная связь вируса Зика с развитием СГБ. Так, отмечался всплеск и последующее снижение случаев СГБ после вспышки вируса Зика в 2014-2016 годах во Французской Полинезии, Латинской Америке и в Карибском бассейне. В период эпидемии заболеваемость на этих территориях временно увеличилась в 2,6 раза по сравнению с фоновой заболеваемостью16. К слову, для СГБ, развившийся после перенесенного вируса Зика, у характерны сенсомоторные нарушения, паралич лицевого нерва и дыхательная недостаточность. А после перенесенной цитомегаловирусной инфекции или вируса Эпштейна-Барр, обычно развивается демиелинизирующая нейропатия15. Учитывая вышесказанное, и зная анамнестически триггерное заболевания, можно с высокой степенью вероятности предположить форму СГБ и прогноз заболевания.
Патогенез
Основной мишенью иммунных атак являются Шванновские клетки и миелин. Происходит активация антигенспецифичных Т- и В-клеток, синтез аутоантител, активация системы комплемента и формирование мембран-атакующего комплекса (МАК). Антигены, на которые нацелен AMAN, расположены в узле Ранвье или рядом с ним. Антитела связываются с аксолеммой, приводя к активации комплемента с последующим образованием MAК и редукцией натриевых каналов. Это повреждение приводит к деструкции миелина и нарушению проведения нервного импульса. Затем макрофаги проникают в периаксональное пространство. Антигены, на которые нацелен AIDP, предположительно расположены на миелиновой оболочке. Антитела могут активировать комплемент, что приводит к образованию MAC на внешней поверхности Шванновских клеток, инициации везикулярной дегенерации и инвазии миелиновой оболочки сенсибилизированными макрофагами. В результате возникает отек и расширение эндоневрального интерстиция, растворение базальной мембраны, деформация леммоцитов. Схематично развитие СГБ показано на рисунке 2.
Рисунок 2.
Роль генетики
Только у одного из 1000-5000 пациентов, перенесших кампилобактерный энтерит, разовьется СГБ в будущем17,18. Это дополнительно указывает на вероятность участия генетической предрасположенности в развитии СГБ. Генетические факторы пока изучались только на небольших когортах пациентов. Выявлена связь между СГБ и конкретным полиморфизмом фактора некроза опухоли19. Также была подтверждена связь между полиморфизмами в гене MBL2 (кодирующем маннозосвязывающий белок C) с тяжестью и исходом СГБ20. Роль генетической восприимчивости требует дальнейшего изучения в больших, хорошо спланированных и адекватно контролируемых когортах.
Синдром Гийена-Барре и вакцинация
Особое внимание следует уделить СГБ, развившемуся после вакцинации. В литературе встречаются описания отдельных случаев развития этого заболевания после вакцинации. Провоцирующим агентом часто становится сезонная противогриппозная вакцинация. Возможно, это связано с тем, что вакцинация от гриппа является ежегодной и относительно массовой. Но так ли страшен черт, как его малюют? В ходе компании вакцинации против гриппа H1N1 в США в 1976 году предполагаемый связанный с вакциной риск СГБ составлял примерно один на 100 000 вакцинированных21. Позже было проведено несколько аналогичных национальных и международных исследований. Они подтвердили, в частности, что вакцинальная компания против гриппа того же штамма H1N1 в 2009 году, была связана с относительно небольшим риском СГБ: 1 случай болезни на 1млн (!) вакцинированных22. Это связывают с технологическим скачком в процессе производства и очистки вакцин.
Вакцинация может даже снизить риск развития СГБ, поскольку риск развития СГБ после перенесенной инфекции выше, нежели поствакцинальный. В частности, риск развития СГБ после перенесенного гриппа в 4-7 раз выше, чем после вакцинации23. О рецидивах заболевания после вакцинаций у пациентов, ранее перенесших СГБ не сообщалось24,25. Несмотря на редкость поствакцинального СГБ, подобные события вызывают значительный общественный резонанс и дают повод для спекуляций антипрививочникам. Манипулируя статистикой эти люди могут спровоцировать вспышки опасных для жизни заболеваний, таких как корь, например.
Список литературы:
- Anil K. Jasti et al., Guillain-Barré syndrome: causes, immunopathogenic mechanisms and treatment. Expert Rev Clin Immunol. 2016 Nov; 12(11):1175-1189.
- Синдром Гийена-Барре. Клинические рекомендации.
- Yuki, N. & Hartung, H. P. Guillain-Barré syndrome. N Engl J Med. 2012 Jun 14; 366(24):2294-2304.
- Емелин А.Ю. Синдром Гийена-Барре: рекомендации по диагностике и лечению. Известия Российской Военно-медицинской академии 2021.Т. 40. No 4. С. 51–57.
- Величко И. А., Барабанова М. А. Синдром Гийена-Барре как актуальная проблема неврологии (обзор литературы). Кубанский научный медицинский вестник. 2019; 26(2): 150–161.
- Anil K. Jasti et al., Guillain-Barré syndrome: causes, immunopathogenic mechanisms and treatment. Expert Review of Clinical Immunology. 2016 Nov; 12(11):1175-1189.
- Geurtsvankessel, C. H. et al. Hepatitis E and Guillain–Barré syndrome. Clin. Infect. Dis. 2013. Nov;57(9):1369-70.
- Нанкина И.В., Дунаевская Г.Н., Бембеева Р.Ц. Идиопатические воспалительные полиневропатии у детей. Лечащий врач. 2008. № 7. С. 24-27.
- Shang P, Zhu M, Wang Y, et al. Axonal variants of Guillain-Barré syndrome: an update. J Neurol; 268(7):2402-2419.
- van den Berg B et al., Guillain–Barré syndrome: pathogenesis, diagnosis, treatment and prognosis. Nat Rev Neurol. 2014 Aug;10(8):469-82. doi: 10.1038/nrneurol.2014.121.
- Willison, H. J. & Yuki, N. Peripheral neuropathies and anti-glycolipid antibodies. Brain 2002. 125, 2591–2625.
- Kaida, K. & Kusunoki, S. Antibodies togangliosides and ganglioside complexes in Guillain-Barré syndrome and Fisher syndrome: mini-review. J. Neuroimmunol. 2010. 223, 5–12.
- Yuki, N. Guillain–Barré syndrome and antiganglioside antibodies: a clinician–scientist’s journey. Proc. Jpn Acad. Ser. B Phys. Biol. Sci. 2012. 88, 299–326.
- Gilbert, M. et al. The genetic bases for the variation in the lipo-oligosaccharide of the mucosal pathogen, Campylobacter jejuni. Biosynthesis of sialylated ganglioside mimics in the core oligosaccharide. J. Biol. Chem. 2002. 277, 327–337.
- Nortina Shahrizaila et al. Guillain-Barré syndrome. Lancet 2021; 397: 1214–28
- Capasso A, et al. Incidence of Guillain-Barré Syndrome (GBS) in Latin America and the Caribbean before and during the 2015–2016 Zika virus epidemic: a systematic review and meta-analysis. PLoS Negl Trop Dis 2019; 13: e0007622.
- Tam, C. C. et al. Incidence of Guillain–Barré syndrome among patients with Campylobacter infection: a general practice research database study. J. Infect. Dis. 2006. 194, 95–97.
- Nachamkin, I., Allos, B. M. & Ho, T. Campylobacter species and Guillain–Barré syndrome. Clin. Microbiol. Rev. 1998. 11, 555–567.
- Wu L. Y., Zhou Y., Qin C. & Hu B. L. The effect of TNF-α, FcγR and CD1 polymorphisms on Guillain-Barré syndrome risk: evidences from a metaanalysis. J. Neuroimmunol. 2012. 243, 18–24.
- Geleijns K. et al. Mannose-binding lectin contributes to the severity of Guillain-Barré syndrome. J. Immunol. 2006. 177, 4211–4217.
- Schonberger L. B. et al. Guillain-Barré syndrome following vaccination in the National Influenza Immunization Program, United States, 1976--1977. Am. J. Epidemiol. 1979. 110, 105–123.
- Salmon D. A. et al. Association between Guillain-Barré syndrome and influenza A (H1N1) 2009 monovalent inactivated vaccines in the USA: a meta-analysis. Lancet 2013. 381, 1461–1468.
- Kwong JC, et al. Risk of Guillain-Barré syndrome after seasonal influenza vaccination and influenza health-care encounters: a self-controlled study. Lancet Infect Dis 2013; 13: 769–76
- Poland G. A., Jacobsen S. J. Influenza vaccine, Guillain–Barré syndrome, and chasing zero. Vaccine 2012. 30, 5801–5803.
- Kuitwaard K., et al. Recurrences, vaccinations and long-term symptoms in GBS and CIDP. J. Peripher. Nerv. Syst. 2009. 14, 310–315
Обсудить последние новости со всеми коллегами России вы можете в чатах:
- WhatsApp:
- Telegram:
- ВКонтакте:





