
Синдром Рейно: причины, лечение, симптомы
Синдром Рейно: патогенез, диагностика и лечение
Синдром Рейно (СР, в зарубежной литературе также известный как феномен Рейно) представляет собой гипертрофированный спазм мелких артерий в ответ на холод или эмоциональный стресс, что клинически проявляется побелением, а затем посинением кожи дистальных отделов пальцев, а также пальцев ног, носа и мочек ушей.
Выделяют первичный СР (идиопатический), который не ассоциирован с каким-либо заболеванием, и вторичный, который является одним из симптомов другой болезни.
Заболевания и состояния, ассоциированные с СР:
- Ревматологические:
- Системная склеродермия
- Системная красная волчанка
- Полимиозит
- Дерматомиозит
- Синдром Шегрена
- Смешанное заболевание соединительной ткани
- Гематологические/онкологические:
- Паранеопластический синдром
- Криоглобулинемия
- Криофибриногенемия
- Холодовой агглютинин
- Парапротеинемия
- Синдром POEMS (Polyneuropathy, Organomegaly, Endocrinopathy, М-protein, and Skin Changes)
- Прием веществ и лекарственных препаратыов:
- Симпатомиметики
- Химиотерапевтические препараты (блеомицин, цисплатин, циклоспорин, бромокриптилин)
- Интерфероны
- Препараты для лечения СДВГ (метилфенидат и декстроамфетамин)
- Антимигренозные препараты (суматриптан, эрготамин).
- Никотин
- Кокаин
- Амфетамин
- Сосудистые заболевания:
- Эмболия
- Васкулиты
- Атеросклероз
- Стенокардия Принцметала
- Профессиональные причины:
- Работа, связанная с вибрацией (например, сверление)
- Действие винилхлорида, ртути
- Прочие:
- Гипотиреоз
- Синдром запястного канала
- Мигрень
- Фибромиалгия
Эпидемиология. Точно установить распространенность СР сложно, поскольку нет четко определенного воспроизводимого диагностического теста и критериев диагноза. В целом, считается, что СР встечается по разным подсчетам у 3-17% населения. Первичный СР чаще встречается у женщин, чем у мужчин, в основном обнаруживается в раннем возрасте [1] и среди населения регионов с холодным климатом [2].
Патогенез. В основе патогенеза первичного синдрома Рейно лежит аномальная вазоконстрикция пальцевых артерий и кожных артериол из-за локального дефекта нормальной сосудистой реакции. При первичном СР повышенная чувствительность к низким температурам связана с аномальными альфа-адренергическими реакциями, преимущественно опосредованными альфа-2-адренорецепторами, которые более выражены на дистальных артериях [3]. Также предполагают и другие механизмы развития синдрома, такие как повышенная продукция эндотелина-1, снижение иннервации чувствительных нейронов, нарушение дилататорной функции эндотелия, снижение активности оксида азота NO, однако ни одно из этих предположений пока не получило убедительных доказательств [3]. Первичный СР может быть обусловлен генетическим дефектом [4,5].
При вторичном синдроме Рейно дефект сосудистой реакции определяется основным заболеванием. Например, при системной склеродермии развиваются нарушения в микрососудистой системе, связанные с фиброзом интимы и дисфункцией эндотелия [6]. Были продемонстрированы и другие изменения, в том числе повреждение и последующая репарация эндотелия [7], повышенный уровень циркулирующего эндотелина-1 и снижение активности оксида азота (NO) [8], а также повышенная экспрессия эндотелиновых рецепторов в микрососудах [9].
Клиническая картина. Типичный эпизод характеризуется внезапным похолоданием пальцев рук или ног в ответ на холод или эмоциональный стресс в сочетании с резко очерченным побледнением кожи из-за ограниченного кровотока с последующим цианотичным цветом кожи (тканевая гипоксия). При согревании ишемическая фаза прекращается через 15-20 минут. Впоследствии кожа краснеет (реперфузионная эритема). Приступ обычно начинается с одного пальца, а затем симметрично распространяется на другие пальцы обеих рук. Наиболее часто вовлекаются указательный, средний и безымянный пальцы, в то время как большой палец часто остается незатронутым. Вовлечение большого пальца может указывать на вторичность заболевания [10]. Кроме того, вазоспазм может наблюдаться в других местах – уши, нос, лицо, колени, соски. Пациенты могут также жаловаться на ощущение покалывания, онемение и/или боль в пальцах. Данные признаки чаще всего полностью обратимы после того, как заканчивает действие триггер. Кроме того, во время приступа у пациентов может появляться сетчатое ливедо – фиолетовая крапчатость или сетчатый рисунок кожи рук и ног, иногда с правильными сплошными кругами. Это явление является доброкачественным и часто полностью обратимо при согревании.
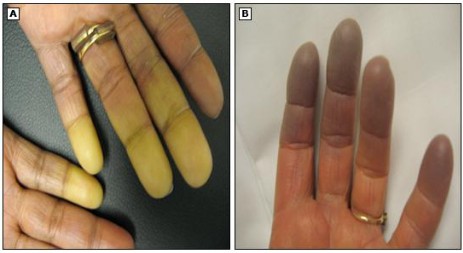
Рис. Типичный вид пальцев при синдроме Рейно, оригинал рисунка.
Первичный СР обычно протекает легче, чем вторичный. При вторичном синдроме могут наблюдаться признаки ишемии от легкой до тяжелой степени, появляться выраженная боль или изъязвление кожи (чаще на кончиках пальцев рук и ног).
Диагностика. К сожалению, не существует простых тестов или стандартных диагностических критериев СР, которые признаны «золотым стандартом» [11]. Попытки вызвать приступ, такие как провокация холодной водой, не рекомендуются, поскольку ответы непостоянны даже у пациентов с подтвержденным диагнозом.
Жалобы: последовательная смена окраски кожи пальцев кистей на холоде, онемение, покалывание, боль во время атаки.
Анамнез: При постановке диагноза зарубежные источники предлагают ориентироваться на три вопроса [12]:
- Ваши пальцы необычайно чувствительны к холоду?
- Меняют ли ваши пальцы цвет, когда они подвергаются воздействию низких температур?
- Ваши пальцы белеют, синеют или и то, и другое?
Если пациент дает положительный ответ на все три вопроса, ему ставят диагноз «синдром Рейно».
Далее необходимо исключить/подтвердить вторичный генез заболевания. Анамнез должен включать возраст начала заболевания, характер и локализацию сосудистых расстройств, степень симметрии и тяжесть приступов, а также наличие изъязвлений на коже. Необходимо уточнить перенесенные и сопутствующие заболевания, предшествующий прием лекарственных препаратов и других веществ, неблагоприятные профессиональные и экологические факторы, наследственность.
Системные симптомы, которые могут указывать на аутоиммунное заболевание: лихорадка, артралгии/артриты, миалгия, дисфагия, кожная сыпь, сердечно-легочные нарушения.
Физикальное обследование: Необходимо оценить наличие признаков ишемии тканей рук и ног (например, изъязвления), а также кожи ушей, носа, лица, коленей и сосков. При наличии склеродактилии следует начать обследование на системную склеродермию. Полный физикальный осмотр должен также включать в себя тщательную оценку состояния опорно-двигательного аппарата и сердечно-легочной системы, поскольку это может свидетельствовать о вторичной причине заболевания.
Инструментальная и лабораторная диагностика:Капилляроскопия ногтевого ложа является наиболее часто используемым в клинической практике методом, помогающим отличить первичный СР от вторичного.Исследование выполняется путем нанесения масла на околоногтевую область и осмотра с помощью офтальмоскопа с диоптрией 40, препаровального микроскопа или специализированного дерматоскопа. Увеличенные или деформированные капиллярные петли и/или выпадение или потеря петель указывают на ревматическое заболевание [13, 14]. Метаанализ 10 статей, включающих около 640 пациентов с диагнозом первичного СР, показал, что аномальный капиллярный рисунок ногтевого ложа является надежным предиктором развития ревматического заболевания [15].
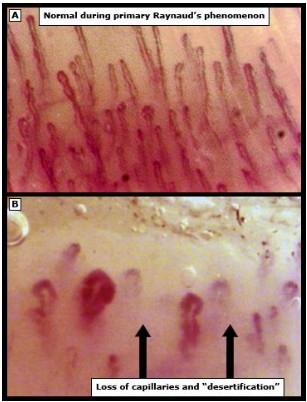
Рис. Увеличение 200x; А – Нормальные капилляры, Б – снижние числа капиллярных петель (вторичный синдром Рейно) (оригинал рисунка).
Другой наиболее часто используемый тест, который позволяет выявить вторичную причину синдрома, это определение антинуклеарных антител (АНА) и антитопоизомеразного (анти-Scl-70) и антицентромерного антител. В большом проспективном исследовании было показано, что комбинация аутоантител и капиллярной микроскопии ногтевого ложа может быть более информативной, чем любой из этих тестов по отдельности [16].
Если результаты тщательного сбора анамнеза и физикального обследования, включая капиллярную микроскопию ногтевого ложа, не позволяют предположить вторичную причину патологической вазоконстрикции, пациенту диагностируется первичный СР. Однако необходимо дальнейшее наблюдение, чтобы исключить появление признаков вторичных причин, поскольку СР часто является первым симптомом аутоиммунного заболевания [17].
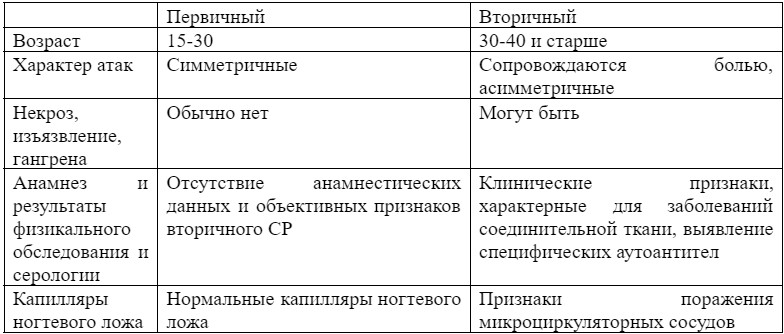
Признаки, указывающие на первичный/вторичный характер СР:
Доступны и другие методы диагностики, но они обычно используются в специализированных центрах или в исследовательских целях:
- Термография
- Ангиография
- Лазерная допплеровская визуализация
- Прямые измерения температуры кожи и местного кровотока.
Лечение
Немедикаментозные меры
- Избегание воздействия холода (включая доставание из морозилки продуктов, использование кондиционера и т.п.). Важно также понимать, что нужно держать в тепле все тело, а не только руки и ноги. Пациентов следует обучить методам купирования приступа СР: помещение рук в теплую воду или подмышечную впадину, вращение и потирание рук друг о друга.
- Избегание травм кончиков пальцев и воздействия вибрации.
- Контроль или ограничение эмоционального стресса, который в сочетании с переохлаждением является особенно мощным триггером для СР.
- Избегание сосудосуживающих препаратов, а также заместительной терапии эстрогенами в случае тяжело протекающего синдрома (имеется ассоциация с женским полом, а также данные, что женщины в постменопаузе, принимающие эстрогены, чаще имеют СР [18]).
- Отказ от курения рекомендован (сосудосуживающее влияние никотина), хотя и имеет ограниченное количество поддерживающих доказательств [19].
Отказ от кофеинсодержащих напитков не имеет под собой доказательной базы, поэтому эксперты рекомендуют основываться на опыте пациента.
Фармакологические методы
У пациентов с неосложненным СР, которые не ответили на немедикаментозные меры, препаратами выбора являются дигидропиридиновые блокаторы кальциевых каналов (БКК) длительного действия (нифедипин, амлодипин). Имеются убедительные доказательства эффективности БКК по сравнению с плацебо, а также накоплен большой опыт их применения [20, 21]. Нет данных, подтверждающих преимущество одного препарата данной группы над другим. Недигидропиридиновые БКК не рекомендовано использовать, потому что их эффективность не доказана [22]. Назначать препараты необходимо с самой низкой дозы, постепенно увеличивая ее по мере необходимости в зависимости от реакции. Эффективные дозы амлодипина колеблются в диапазоне от 5 до 20 мг/сутки, а нифедипина длительного действия – от 30 до 120 мг/сутки. Дозу корректируют каждые четыре недели и не чаще, чем каждые 7–10 дней, во время титрования дозы требуется регулярное измерение АД. Если нифедипин или амлодипин неэффективны в максимально переносимой дозе, то препарат можно заменить другим дигидропиридиновым БКК.
Пациентов, резистентных к начальной терапии, включая общие немедикаментозные меры и максимально переносимые дозы БКК, ведут по следующему алгоритму (Клинические рекомендации Ассоциации ревматологов России):
1. Еще раз подчеркивают важность продолжения общих немедикаментозных мер профилактики и лечения;
2. Пересматривают основную причину СР, чтобы обнаружить обратимые причины или поддающиеся лечению сопутствующие заболевания;
3. Заменяют или добавляют один препарат из следующего списка:
- Ингибитор фосфодиэстеразы типа 5 (ФДЭ) (например, силденафил)
- Лозартан
- Флуоксетин
При непереносимости БКК или наличии противопоказаний (например, легочная гипертензия, тяжелое нарушение моторики желудочно-кишечного тракта, заболевание сердца с отеками, пониженное АД) назначают ингибиторы ФДЭ 5 (силденафил). Метаанализ шести рандомизированных исследований, включающих 244 пациента с вторичным СР, продемонстрировал умеренное преимущество ингибиторов ФДЭ в отношении частоты и продолжительности приступов [23]. С другой стороны, существуют исследования, указывающие на значительную неоднородность клинических эффектов препаратов [24]. Силденафил назначают в низких дозах (20 мг один раз в день), при отсутствии эффекта дозу увеличивает до 20 мг три раза в день. Доза может быть также дополнительно увеличена до 40 мг три раза в день у пациентов, которые не реагируют на лечение и могут переносить более высокие дозы. Как и в случае с БКК, необходим регулярный контроль АД.
Блокаторы рецепторов ангиотензина II (БРА, лозартан) могут назначаться пациентам с неосложненным СР, которые не переносят БКК или которые имеют сопутствующие заболевания, требующие назначения БРА (например, артериальная гипертензия, сердечная недостаточность, протеинурическая хроническая болезнь почек). Имеются ограниченные данные, подтверждающие эффективность использования БРА при СР [25]. Лозартан назначают в дозе 12,5-50 мг 1-2 раза в сутки.
Селективные ингибиторы обратного захвата серотонина (флуоксетин) можно использовать у пациентов с неосложненным СР, которые не переносят БКК или другие альтернативные препараты. В небольшом исследовании, включавшем 53 пациента с первичным или вторичным СР, применение флуоксетина привело к снижению частоты приступов и тяжести заболевания [26]. Рекомендовано начинать с дозы 10 мг в день в течение одной недели для обеспечения переносимости, а затем постепенно увеличивать дозу до 20 мг в день.
Комбинация препаратов. Нет рандомизированных исследований, посвященных эффективности комбинированной терапии БКК и другого сосудорасширяющего ЛС, и обоснование этого подхода основано на преимуществах, наблюдаемых при применении отдельных агентов. Перед началом комбинированной вазодилатационной терапии необходимо тщательно оценить сердечно-легочный статус (например, легочную гипертензию), а также требуется регулярный контроль АД.
Препараты с недоказанной эффективностью:
- Ингибиторы ангиотензинпревращающего фермента (ИАПФ) [27]
- Альфа1-адреноблокаторы (празозин, не зарегитрирован в РФ) [28, 29]
При отсутствии ответа на пероральные или местные вазодилататоры у пациентов с ишемией пальцев или высоким риском ее развития зарубежные эксперты рекомендуют использовать внутривенные простагландины, предпочтительнее аналоги простациклина (PGI2) (илопрост). Однако данный тип лечения довольно дорогостоящий и требует проведения процедуры в стационаре и/или наличия системы мониторинга. Эффективность илопроста у пациентов с тяжелой дигитальной ишемией подтверждается многочисленными рандомизированными исследованиями, а также систематическими обзорами и метаанализами [30, 31]. Илопрост вводят в дозе 10-60 мг со скоростью от 0,5 до 2 нг/кг в минуту в течение 5-15 дней. БКК и другие препараты, например, ингибиторы ФДЭ 5 типа, отменяют на время инфузии, но продолжают принимать после парентерального лечения. Что касается PGE1 (алпростадил), то его эффективность для лечения СР не была доказана [32].
Для профилактики новых дигитальных язв у пациентов с системной склеродермией могут применяться антагонисты эндотелина-1 (например, бозентан). В нескольких рандомизиованных исследованиях продемонстрировано снижение частоты образования новых язв у таких пациентов [33]. Лечение бозентаном начинают с дозы 62,5 мг 2 раза в сутки в течение 4 недель. Доза может быть увеличена до 125 мг два раза в день у пациентов, которым не помогает начальная доза. Ежемесячно пациентам необходимо проводить функциональные печеночные тесты.
Доказательства использования статинов у пациентов с системной склеродермией с рецидивирующими дигитальными язвами ограничены [34], однако статины можно использовать в качестве альтернативы бозентану, если он недоступен, неэффективен или плохо переносится.
Хирургические методы
Хирургическое лечение проводится только пациентам с тяжелым СР и сохраняющейся ишемией ткани, которым не помогло медикаментозное лечение. У пациентов с изъязвлением пальцев с критической ишемией, когда пероральная и/или местная сосудорасширяющая терапия не приводит к улучшению кровотока в пальцах, а простагландины недоступны, выполняют временную химическую симпатэктомию с пальцевой или регионарной блокадой или хиругическую симпатэктомию.
Химическая симпатэктомия не подвергалась систематической оценке в клинических испытаниях. Временная локальная химическая симпатэктомия, которая может устранить вазоконстрикцию и снять боль, включает пальцевую или регионарную (например, запястье) блокаду с местной инфильтрацией лидокаином или бупивакаином (без адреналина).
Временная шейная или поясничная симпатэктомия используется редко, в тех случаях, когда другие подходы оказались безуспешными, поскольку она не дает долговременного эффекта; однако иногда она эффективна для временного купирования острого вазоспазма [35]. В качестве альтернативы может применяться локализованная хирургическая пальцевая симпатэктомия. Хотя в ряде случаев сообщалось об успешных результатах и небольшом количестве послеоперационных осложнений [36, 37], точная роль метода не была определена в контролируемых исследованиях. Симпатэктомия более эффективна при первичном СР, однако этим пациентам редко требуется агрессивный хирургический подход к терапии. Пациенты со вторичным СР с критической ишемией или активными язвами пальцев, вероятно, получают некоторое улучшение кровотока, но степень и продолжительность улучшения весьма вариабельны.
Дополнительные методы лечения включают антикоагулянты, анальгетики, антибиотики и хирургическую обработку по клиническим показаниям.
Течение и прогноз. В целом, прогноз заболевания благоприятный. Нередко может наблюдаться спонтанная ремиссия первичного СР в течение 7–14 лет наблюдения [38-39]. Тем не менее, многие пациенты (более 25% по данным одного из международных исследований [40]) сообщают о том, что синдром Рейно оказывает значительное влияние на качество их жизни, особенно если их профессия связана с холодом. Напротив, ремиссия у пациентов со вторичным СР встречается редко. У них более вероятны развитие тяжелых приступов вазоконстрикции и неуклонная прогрессия заболевания. У пациентов с сопутствующим системным ревматическим заболеванием (особенно системная склеродермия) может развиться стойкая дигитальная ишемия, рефрактерная к терапии. Кроме того, опрос 443 пациентов с первичным или вторичным СР из 15 стран показал, что 64% сообщили о плохой или очень плохой способности предотвращать или контролировать приступы, несмотря на изменения образа жизни и лечение [41].
ССЫЛКИ
- Ling SM, Wigley FM. Drugs Aging 1999; 15:183-195.
- Maricq HR, et al. J Rheumatol 1997; 24:879-889.
- Herrick AL. Rheumatology (Oxford). 2005; 44:587-596.
- MacGregor AJ, et al. Arthritis Rheum. 2000; 43:30-37.
- Susol E, et al. Arthritis Rheum 2000; 43:1641-1646.
- Wigley FM. Clin Rev Allergy Immunol 2009; 36:150-157.
- Fleischmajer R, Perlish JS. J Invest Dermatol 1977; 69:379-382.
- Freedman RR, et al. Lancet 1999; 354:739.
- Vancheeswaran R, et al. J Rheumatol 1994; 21:1268-1276.
- Chikura B, et al. J Rheumatol 2010; 37:783-786.
- Maverakis E, et al. J Autoimmun 2014; 48-49:60-65.
- Raynaud's Phenomenon: A Guide to Pathogenesis and Treatment, Wigley FM, Herrick AL, Flavahan NA (Eds), Springer, New York 2015
- Ingegnoli F, et al. Arthritis Rheum 2008; 58:2174-2182.
- Lambova SN, Müller-Ladner U. Rheumatol Int 2009; 29:1263-1271.
- Spencer-Green G. Arch Intern Med 1998; 158:595-600.
- Koenig M, et al. Arthritis Rheum 2008; 58:3902-3912.
- Pavlov-Dolijanovic S, et al. Rheumatol Int 2013; 33:921-926.
- Fraenkel L, et al. Ann Intern Med 1998; 129:208-211.
- Hudson M, et al. Arthritis Rheum 2011; 63:230-238.
- Ennis H, et al. Cochrane Database Syst Rev 2016; 2:CD002069.
- Rirash F, et al. Cochrane Database Syst Rev 2017; 12:CD000467.
- Kahan A, et al. Angiology 1987; 38:333-337.
- Roustit M, et al. Ann Rheum Dis 2013; 72:1696-1699.
- Roustit M, et al. Ann Intern Med 2018; 169:694-703.
- Dziadzio M, et al. Arthritis Rheum 1999; 42:2646-2655.
- Coleiro B, et al. Rheumatology (Oxford) 2001; 40:1038-1043.
- Gliddon AE, et al. Arthritis Rheum 2007; 56:3837-3846.
- Wollersheim H, et al. Clin Pharmacol Ther 1986; 40:219-225.
- Wollersheim H, Thien T. J Clin Pharmacol 1988; 28:1089-1093.
- Pope J, et al. Cochrane Database Syst Rev 2000; 2:CD000953.
- Wigley FM, et al. A multicenter, placebo-controlled, double-blind study. Ann Intern Med 1994; 120:199-206.
- Gardinali M, et al. J Rheumatol 2001; 28:786-794.
- Matucci-Cerinic M, et al. Ann Rheum Dis 2011; 70:32-38.
- Abou-Raya A, et al. J Rheumatol 2008; 35:1801-1808.
- Setacci C, et al. Eur J Vasc Endovasc Surg 2011; 42 Suppl 2:S43
- Yee AM, et al. J Rheumatol 1998; 25:269-276.
- Tomaino MM, et al. Microsurgery 2001; 21:75-79.
- Carpentier PH, et al. J Vasc Surg 2006; 44:1023-1028.
- Suter LG, et al. Arthritis Rheum 2005; 52:1259-1263.
- Murphy SL, et al. Clin Rheumatol 2021; 40:1611-1616.
- Hughes M, et al. Rheumatology (Oxford) 2015; 54:1443-1447.
Image by Freepik






