Модифицированные бактерии защищают кишечник от антибиотиков
Новая страница в антибиотикотерапии
11 апреля 2022 года исследователи из Гарвардского университета и Массачусетского технологического института опубликовали в журнале Nature Biomedical Engineering исследование1 о создании специальных бактерий, которые потенциально могут защитить людей от вредных побочных эффектов антибиотиков (АБ).
Антибиотики не безвредны
По данным ВОЗ ежегодное глобальное использование антибиотиков составляет около 77 миллиардов доз2, из которых β-лактамы составляют примерно 48 миллиардов доз (62 %). Когда из системной циркуляции АБ попадает в кишечник посредством экскреции с желчью, может развиваться дисбактериоз кишечника и такие осложнения, как:
- диарея
- воспалительные заболевания
- вторичные инфекции и т.д.
Широкое использование АБ способствует активному распространению резистентных микроорганизмов по всему миру, и ситуация становится только хуже. Некоторые врачи для восстановления нормальной кишечной микробиоты прописывают пробиотики, однако АБ также могут негативно влиять на пробиотики.
Новый подход
Ведущий автор исследования, Andrés Cubillos-Ruiz, вместе с коллегами считает, что с «живым биотерапевтическим» или сконструированным штаммом бактерий ситуация с АБ-ассоциированным дисбактериозом может улучшиться. Они модифицировали грамположительный штамм Lactococcus lactis, который безопасен для употребления в пищу и часто используется в производстве сыра. Модифицированный микроорганизм доставляет в микробиоту фермент, способный расщеплять бета-лактамные АБ. Под эту категории подходят многие часто назначаемые в России АБ, включая пенициллин, ампициллин, амоксициллин и другие.
Суть разработки
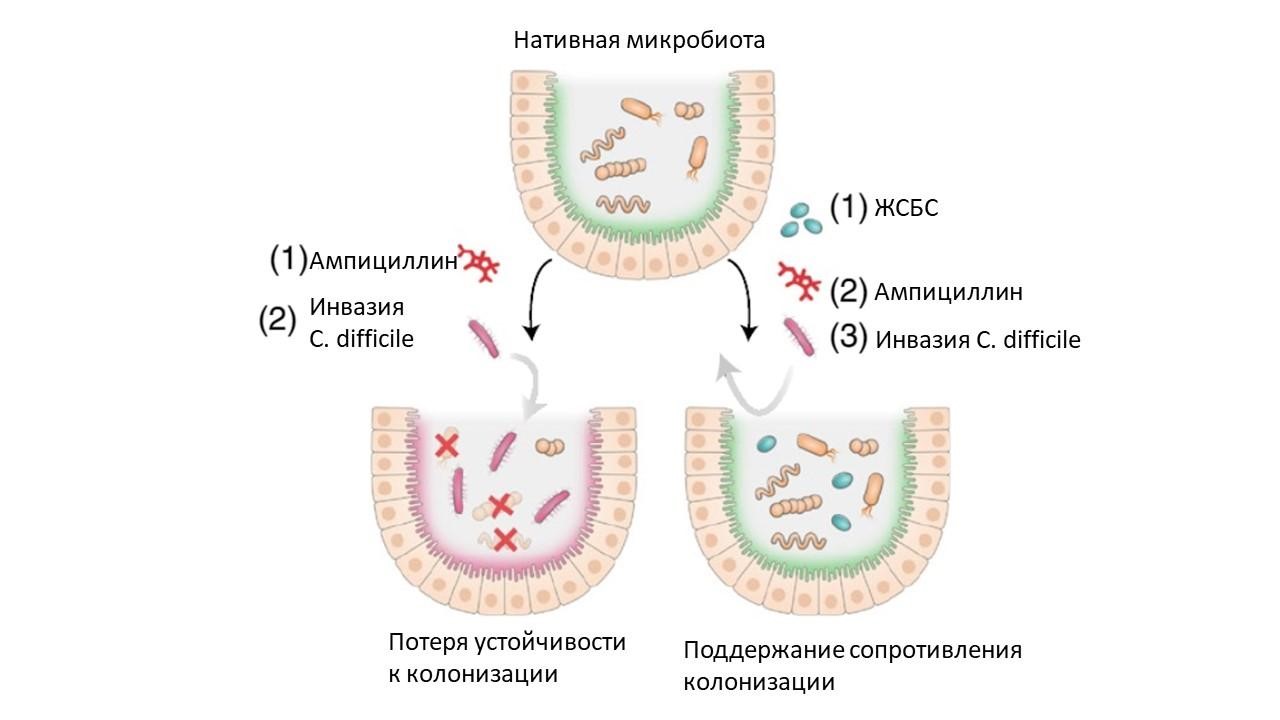
Поскольку присутствие АБ в кишечнике требуется только при лечении желудочно-кишечных инфекций, АБ следует исключить из дистального отдела кишечника во всех остальных случаях для сохранения нативной микробиоты.
Принцип работы живого сконструированного биотерапевтического средства (ЖСБС) на основе модифицированной L.lactis заключается в том, что штамм расщепляет β-лактамные АБ за счёт секреции и внеклеточной сборки гетеродимерной β-лактамазы. С помощью редактирования генов ученые изменили способ синтеза фермента бактериальным штаммом, чтобы предотвратить передачу этой способности другим бактериям. В итоге сконструированная система экспрессии β-лактамаз не подвержена распространению путем горизонтального переноса генов между бактериями. Иными словами, лечение снижает вредное воздействие АБ, но при этом позволяет им все так же работать против инфекций. Причем проглоченная L.lactis проходит через кишечник без долгосрочной колонизации, оставаясь метаболически активной на протяжении всего пути прохождения по кишечнику, и не влияет на состав микробиоты хозяина, что говорит о потенциальной безопасности и эффективности метода.
Механизм действия ЖСБС для предотвращения вызванной ампициллином потери резистентности к колонизации C. difficile
После 3-дневного лечения ампициллином у мышей контрольной группы произошло резкое снижение бактериального разнообразия, и до конца эксперимента они не восстанавливались до исходных значений. Тогда как пероральный прием ЖСБС минимизировал дисбактериоз кишечника, не влияя на концентрацию ампициллина в сыворотке, а также предотвращал обогащение генов устойчивости к противомикробным препаратам в кишечном микробиоме и не допускал потери колонизационной резистентности против Clostridioides difficile.
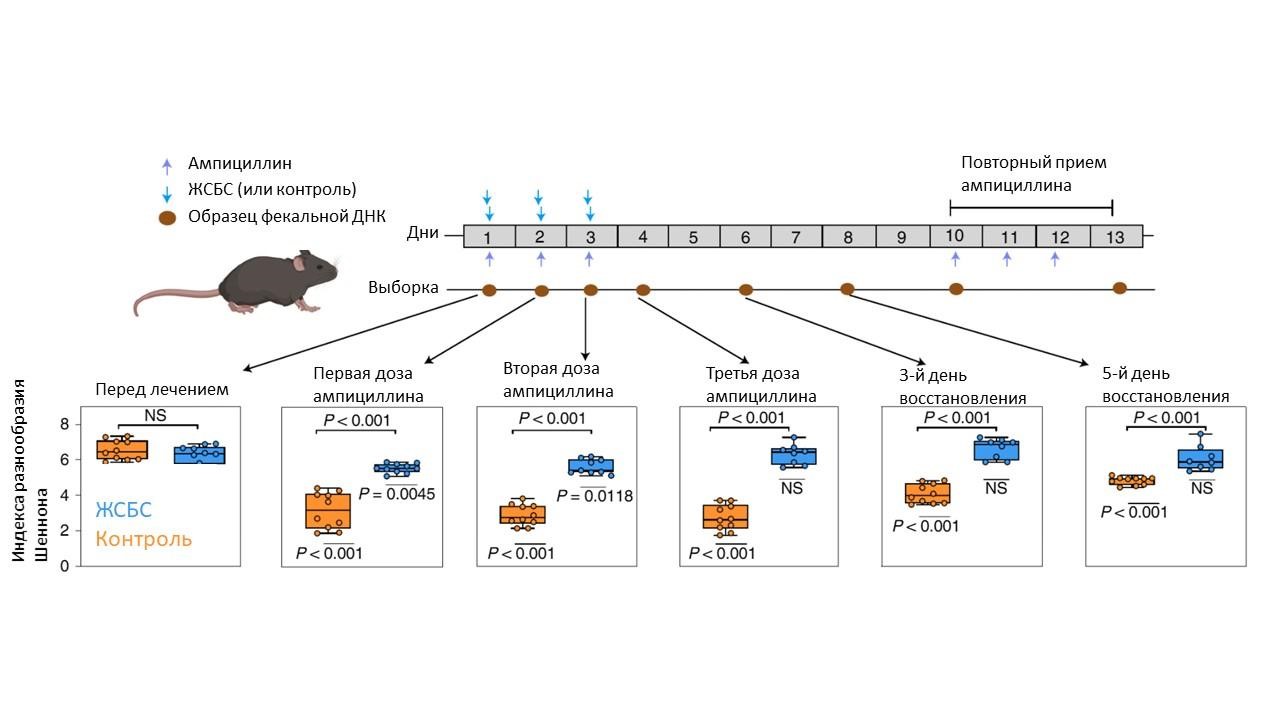
Определение индекса разнообразия Шеннона для микробных сообществ кишечника у мышей до, во время и после лечения. ЖСБС показывает хорошие результаты по сравнению с контрольной группой
Оптимистичный вывод
Использование АБ является самым сильным, но наиболее предсказуемым нарушением микробиоты кишечника. Поскольку фармакокинетические свойства АБ для клинического применения хорошо изучены, можно разработать своевременные профилактические меры, чтобы свести к минимуму влияние АБ кишечную флору. Также прием ЖСБС заметно снижает антибиотикорезистентность кишечной микробиоты и позволяет применять АБ шире и безопаснее. Таким образом, пероральное введение ЖСБС перед парентеральным введением АБ может значительно снизить заболеваемость и смертность среди пациентов, столкнувшихся с бактериальной инфекцией. Однако ученым еще предстоит усовершенствовать технологии и провести клинические исследования на людях, чтобы в полной мере доказать эффективность и безопасность нового средства. На данный момент ЖСБС является одной из самых перспективных разработок в этом направлении.
- Cubillos-Ruiz, A., Alcantar, M. A., Donghia, N. M., Cárdenas, P., Avila-Pacheco, J., & Collins, J. J. (2022). An engineered live biotherapeutic for the prevention of antibiotic-induced dysbiosis. Nature Biomedical Engineering, 1-12.
- World Health Organization. (2018). WHO report on surveillance of antibiotic consumption: 2016-2018 early implementation.
Обсудить последние новости со всеми коллегами России вы можете в чатах:
- WhatsApp: https://chat.whatsapp.com/Izj3ZQ7aI36KK8e2dCjcm4
- Telegram: https://tglink.ru/joinchat/GWBPCkkLipQUnTbXrKqzGA
- ВКонтакте: https://vk.me/join/AJQ1dzabQRfHvl5Y2AOVUsgJ





